- 2015-11-05
- 0.0 Reitingas
- 5400 Peržiūros
- Komentarai
Žiūrint į žmogaus kūną kaip į sąveikaujančių molekulinių tinklų sistemą, o sistemos sutrikimams pritaikant nanotechnologijas, galima išgydyti ligas o, galbūt, ir jų išvengti.
Viena iš pagrindinių medicinos vystymosi krypčių yra nepaprasta technologijų miniatūrizacija, leidžianti diagnozuoti iš miniatiūrinio kraujo kiekio ar net kelių sergančio audinio ląstelių. Tokios priemonės, veikiančios mikronų ar nanometrų (milijardinių metro dalių) lygyje, gali sparčiai manipuliuoti ir išmatuoti didelį kiekį biologinių ląstelių, - be galo tiksliai ir nepaprastai pigiai. Tas nuostabus galimybių ir kainos santykis atveria naujus kelius ligų tyrimui bei gydymui – į kūną žiūrint kaip dinaminę molekulių sąveikų sistemą.
 |
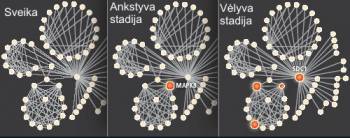
Sistemos modelio sudarymui reikia didelio duomenų kiekio, o gyvi organizmai sklidini informacijos, kurią galima išreikšti skaitmeniniu būdu – išmatuoti, suskaičiuotos ir suprogramuotos į modelį. Tokia biologinė informacija prasideda nuo organizmo genetinio kodo. Kiekviena žmogaus ląstelė turi pilną žmogaus genomo kodą, sudarytą iš 3 mlrd. DNR bazinių elementų, genetinio alfabeto raidžių. Tos „raidės“ užkoduoja apie 25 tūkst. genų, esančių vykdymo komandomis ląstelėms bei audiniams. Kiekvienos ląstelės viduje genai pertvarkyti į labiau portatyvią formą, savitus RNR fragmentus, pernešančius tą informaciją į ląstelės instrumentus, kurie nuskaito RNR ir pagal užkoduotas instrukcijas sudėlioja amino rūgščių grandinėles. Šios amino rūgščių grandinėlės, savo ruožtu, virsta proteinais, trimatėmis molekulinėmis mašinomis, atliekančioms daugumą gyvybinių funkcijų.
Biologinėms sistemoms, tokioms kaip žmogus, visi šie „duomenys“ yra perduodami, apdorojami, integruojami ir vykdomi proteinų tinklo, kuriame jie sąveikauja vienas su kitu bei kitomis biologiškai susijusiomis molekulėmis ląstelėje. Į visą sistemą pasižiūrėjus kaip į tokių tarpusavyje susijusių įvykių tinklą, ligą galima laikyti kažkuo, kas sutrikdo normalią užprogramuotą informacijos cirkuliaciją. Priežastimi gali būti sutrikimas sistemoje, pvz., atsitiktinis DNR pasikeitimas pakeitęs užkoduotą instrukciją ar net išorinės aplinkos poveikis (ultravioletiniai spinduliai, pažeidę DNR). Pradinis sutrikimas sukelia ratilų (arba domino) efektą, informacinė struktūra vis keičiasi ir galiausiai pasireiškia kaip liga.
Žinoma, tikslaus kompiuterinio modelio sudarymas yra rimtas iššūkis. Jis reikalauja milijono ar net daugiau „vežiko“ RNR matavimų ir proteinu lygių skaitmeninės integracijos, kad pajustume sistemos perėjimą iš sveikos būsenos į sergančiąją.
Paskutiniaisiais metais iš visų ligų labiausiai tiriamas buvo vėžys. Tačiau tradiciškai tebelaikoma, kad augliai apibūdinami gana negriežtomis charakteristikomis, tokiomis kaip naviko dydis, vieta pažeistame organe ar audinyje, ar piktybiškos ląstelės pasklidusios už to organo ribų ir pan. Kuo tikslesnė vėžio diagnozė, tuo mažiau niūri perspektyva pacientui. Tačiau diagnozavimas pilnas prieštaravimų. Net nustačius pacientams vienodą vėžį ir skyrus vienodą gydymą, jų organizmai reaguoja skirtingai – vieni greitai pasveiksta, o kitų padėtis sparčiai pablogėja.
Išsamūs RNR ir proteinų koncentracijų matavimai augliuose atskleidė, kad tradiciškai vienodai atrodančių navikų tinklai išsiplėtoję visiškai skirtingai. Remiantis tokia molekuliarine analize, nemažai vėžio atvejų, laikytų
vienu susirgimu, dabar gali būti identifikuoti esą skirtingais susirgimais.
Apie 80% prostatos navikų auga taip lėtai, kad niekada nepradeda žaloti savo „namus“. Likusieji 20 auga sparčiai, apimdami aplinkinius audinius ir net išplisdami į toli esančius organus (metastazės) ir sukeldami mirtiną pavojų pacientui. Tad svarbu tiksliai nustatyti, kuris tų tipų vystosi. Tai padėtų 80-čiai procentų pacientų neversti operuotis, gydytis chemoterapija, ką lydi skausmai, nenulaikymas ir impotencija. Kitai 20% pacientų daliai galima būtų skirti skirtingus gydymo režimus.
Kraujas skalauja kiekvieną kūno organą, nunešdamas šalin proteinus ir kitas molekules, tad yra puikus langas į visą kūno sistemą. Galimybė aptikti atskirų proteinų ar RNR balanso sutrikimus gali būti signalu apie ligą. Nustatyta, kad kiekvienas žmogaus organas turi 50 ar daugiau RNR tipų, labiausiai būdingų tam organui. Neabejotinai tie RNR koduoja specifinius organui proteinus, kurie išskiriami į kraują, o kiekvieno jų lygis atspindi tinklo, kuris valdo jų gamybą organe, veikimą. Ligos atveju šių proteinų lygis pakinta, o tai leidžia gana tiksliai nustatyti ligą. O ankstyva diagnozė palengvina ligos gydymą.
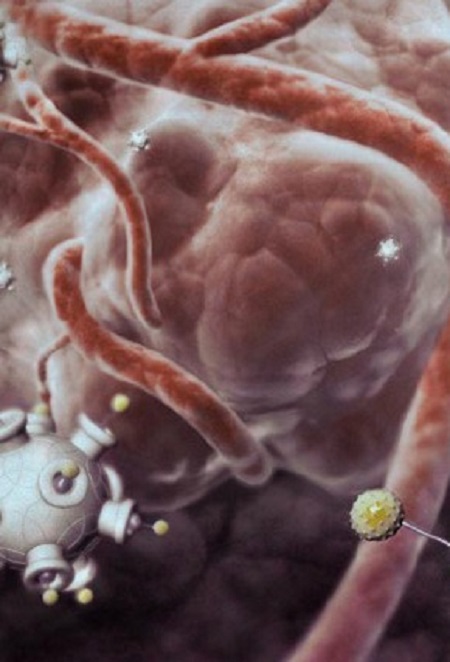
Mažytės ir nutaikytos
Nanodalelės yra lamai mažos lyginant su mus supančiais daiktais, tačiau labai stambios, lyginant su molekulėmis - ir kartu užtikrina nepaprastą vaistų efektyvumą. Vaistų dozės gali būti įkapsuliuotos į sintetines medžiagas (polimerus ar lipidus), o prie paviršiaus pritvirtinti agentai (pvz., antikūniai) padeda jas nugabenti į paskirties vietą, nes šie prilimpa prie tam tikrų proteinų. Tokia modulinė struktūra užtikrina nepaprastą lankstumą ir platų taikymų ratą.
Nanodalelių dydis suteikia joms ir įvairių naudingų savybių. Mažesnės nei 10 nm greitai pašalinamos iš organizmo per inkstus, o didesnės nei 100 nm sunkiai skverbiasi pro audinius. Tad tinkamiausias dydis yra 10-100 nm. Auglių kraujo indai yra pakitę ir turi didesnes poras, pro kurias nanodalelėms lengviau pranikti, tad jos turi tendenciją kauptis navikuose.
Bet net kai įprasti vaistai patenka į auglio ląsteles, jų proteinai gali juos išstumti nespėjus jiems veikti – tai įprastinis atmetimo mechanizmas. Nanodalelės į ląstelę patenka per endocitozę, - tai natūralus svetimo objekto patekimo į ląstelę, apeinant atmetimo mechanizmą, būdas. Nanodalelė, išlaisvinusi vaistus, suyra ir smulkios polimero molekulės pašalinamos per inkstus.
Tai tik pradžia. Tada bus galima sukurti terapeutinę sistemą, kuri galės derinti vaistus, kiekvieną skirdami nustatyta tvarka (pvz., pradžioje skiriant vaistą, kuris nuslopina pasipriešinimą kito vaisto efektyviam panaudojimui) ir asmeninėmis dozėmis.
Pilnas vaizdelis
Ligos, kaip sutrikimo sistemoje, supratimas skatina daugelio naujų technologijų vystymąsi. Per artimiausius 10-20 m. prediktyvioji ir personalizuota medicina apims bent du naujus aspektus: a) individualių žmogaus genomų seka leis gana tiksliai nuspėti tikėtiną sveikatos būklę ateityje; b) nebrangūs kraujo proteinų matavimai leis įvertinti, kaip vystosi asmens sveikata.
Prevencinė medicina prasideda proteinų identifikavimu sergančiame tinkle, kad, esant nukrypimams, būtų atstatyta tinklo elgsena ir paskiriami profilaktiniai vaistai, užkertantys kelią ligai. Pvz., moteris su padidinta rizika susirgti gimdos vėžiu, 30 m. amžiaus ėmusi taikyti nanoterapiją, skirtą molekuliariniam rizikos šaltinio pašalinimui, gali sumažinti tikimybę susirgti vėžiu nuo 40% iki 2%.
Papildomi skaitiniai:
- J.R. Heath et al. NanoSystems Biology// Molecular Imaging and Biology, vol.5, no 5, 2003
- R. Fan et al. Integrated Barcode Chips for Rapid, Multiplexed Analysis of Proteins in Microliter Quantities of Blood// Nature Biotechnology, Nov.16, 2008
- M.E. Davis et al. Nanoparticle Therapeutics: An Emerging Treatment Modality for Cancer// Nature Reviews Drug Discovery, vol.7 no 9, 2008
...kadangi jau perskaitėte šį straipsnį iki pabaigos, prašome Jus prisidėti prie šio darbo. Skaitykite „Paranormal.lt“ ir toliau, skirdami kad ir nedidelę paramos sumą. Paremti galite Paypal arba SMS. Kaip tai padaryti? Iš anksto dėkojame už paramą! Nepamirškite pasidalinti patikusiais tekstais su savo draugais ir pažįstamais.
Susijusios naujienos:
Komentarai su keiksmažodžiais bus šalinami automatiškai, be atsiprašymo.
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau