- 2022-08-23
- 0.0 Reitingas
- 1217 Peržiūros
- Komentarai
"Aduhelm" - tai prekės ženklas, kuriuo prekiaujama vaistu nuo Alzheimerio ligos adukanumabu. Jį sukūrė JAV bendrovė "Biogen". Vaistas turi būti vartojamas kaip infuzija į veną kas keturias savaites.
Maisto ir vaistų administracija (FDA) 2021 m. birželį patvirtino "Aducanumab" - tai pirmasis nuo 2003 m. FDA patvirtintas vaistas nuo Alzheimerio ligos. Tai taip pat pirmasis kada nors patvirtintas vaistas nuo Alzheimerio ligos, nukreiptas prieš smegenyse esančias beta amiloido (tam tikros rūšies baltymo) plokšteles.
Autorius: Kelly Song "The Epoch Times" (paryškinta mūsų),
Tačiau beveik viskas, kas susiję su šiuo vaistu, yra prieštaringai vertinama, pradedant teorija, kuria remiantis sukurtas vaistas, klinikinių tyrimų duomenimis ir baigiant pačiu FDA patvirtinimu. Šiame straipsnyje siekiama išskaidyti sudėtingą informaciją iki kelių punktų, kurie galėtų padėti pacientams priimti labiau pagrįstus sprendimus.
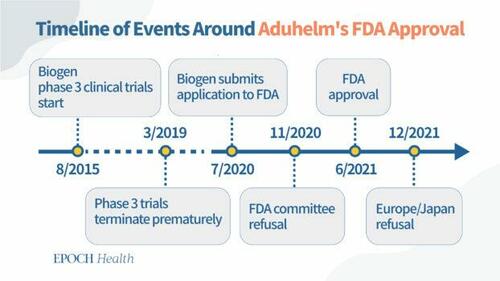
Pagrindinės datos, susijusios su FDA patvirtinimu dėl adukanumabo
2020 m. liepos mėn: Bendrovė "Biogen" baigia pateikti FDA adukanumabo duomenis (iš anksčiau nutrauktų klinikinių tyrimų).
2020 m. lapkričio mėn: FDA išorės patariamasis komitetas atmeta adukanumabą, nes duomenys neįrodo vaisto veiksmingumo mažinant Alzheimerio liga sergančių pacientų pažinimo funkcijų mažėjimą.
2021 m. birželio mėn: FDA suteikia pagreitintą adukanumabo patvirtinimą visų Alzheimerio ligos stadijų pacientams su sąlyga, kad "Biogen" atliks po patvirtinimo atliekamus tyrimus (4 fazės tyrimus) vaisto veiksmingumui patikrinti.
"Biogen" probleminiai klinikiniai tyrimai
2015 m. rugpjūčio mėn. bendrovė "Biogen" pradėjo du praktiškai identiškus 3 fazės klinikinius tyrimus, siekdama įvertinti skirtingų adukanumabo dozių saugumą ir veiksmingumą ankstyvosios Alzheimerio ligos stadijos pacientams.
Tačiau 2019 m. kovo mėn. bendrovė "Biogen" nutraukė tyrimus po to, kai nepriklausomas duomenų stebėsenos komitetas, atlikęs tarpinę beprasmiškumo analizę, numatė, kad tyrimai greičiausiai nepasieks pirminių rezultatų.
Tik po septynių mėnesių netikėtai paskelbtame pranešime spaudai "Biogen" atšaukė savo ankstesnį sprendimą, nurodydama, kad nauja analizė su dar trijų mėnesių duomenimis davė teigiamų rezultatų. Bendrovė teigė: "Teigiamus šios naujos analizės rezultatus pirmiausia lėmė didesnis didelės adukanumabo dozės poveikis didesniame duomenų rinkinyje, palyginti su duomenimis, kurie buvo prieinami bevertiškumo analizės metu." Tame pačiame pranešime spaudai "Biogen" pranešė apie savo planus teikti paraišką dėl FDA patvirtinimo: "Remdamasi diskusijomis su FDA, bendrovė planuoja 2020 m. pradžioje pateikti biologinio vaisto licencijos paraišką".
FDA suteikė patvirtinimą nepaisant ekspertų nepritarimo
Įprasta, kad FDA kviečia ekspertus, kurie "nepriklauso vyriausybei ir turi minimalų interesų konfliktą", sudaryti išorinius patariamuosius komitetus ir teikti neįpareigojančias rekomendacijas, kurias FDA turi apsvarstyti. Periferinės ir centrinės nervų sistemos vaistų patariamasis komitetas 2020 m. lapkritį beveik vienbalsiai balsavo prieš adukanumabo patvirtinimą. Iš 11 komiteto narių 10 balsavo prieš patvirtinimą, o vienas buvo neaiškus.
Po septynių mėnesių, 2021 m. birželį, FDA suteikė pagreitintą adukanumabo patvirtinimą kaip vaisto, skirto visų Alzheimerio ligos stadijų pacientams gydyti. Pasak FDA, pagreitintas patvirtinimas "leidžia vaistus, skirtus rimtoms ligoms, kurios užpildė nepatenkintą medicininį poreikį, patvirtinti remiantis pakaitiniu galutiniu tašku". Adukanumabo "pakaitinis galutinis rodiklis" buvo amiloido-beta plokštelių sumažėjimas.
FDA Vaistų vertinimo ir tyrimų centro direktorė Dr. Patrizia Cavazzoni pareiškime po patvirtinimo rašė, kad klinikinių tyrimų duomenys rodo, jog amiloido-beta plokštelių mažėja, todėl "tikimasi, kad dėl to sumažės klinikinis šios niokojančios demencijos formos nuosmukis". Cavazzoni taip pat pripažino, kad "pareiškėjo pateikti duomenys buvo labai sudėtingi ir paliko likusių neaiškumų dėl klinikinės naudos".
Kitaip tariant, nors "Biogen" klinikinių tyrimų duomenys neįrodė, kad vaistas gali sulėtinti pacientų kognityvinių funkcijų blogėjimą, jie parodė, kad amiloido beta plokštelių kiekis sumažėjo. FDA skubiai patvirtino vaistą, remdamasi prielaida, kad amiloido-beta plokštelių sumažėjimas "turėtų sulėtinti" Alzheimerio liga sergančių pacientų pažintinių funkcijų silpnėjimą.
Kartu su patvirtinimu FDA suteikė "Biogen" dar vieną galimybę įrodyti, kad ši prielaida yra teisinga, atlikus po patvirtinimo atliekamus tyrimus (4 fazės tyrimus), kurie turi būti atlikti iki 2030 m. vasario mėn. Tai reiškia, kad "Aduhelm" bus rinkoje devynerius metus, kol bus reikalaujama įrodyti jo veiksmingumą. Jei praėjus devyneriems metams po pagreitinto patvirtinimo vaisto gamintojas neįrodys klinikinės naudos, FDA gali pašalinti vaistą iš rinkos.
Dar viena detalė apie FDA patvirtinimą yra ta, kad iš pradžių vaistas buvo patvirtintas visų Alzheimerio ligos stadijų pacientams gydyti. Praėjus mėnesiui po patvirtinimo, FDA apribojo gydymą tik ankstyvąja Alzheimerio ligos stadija sergantiems pacientams.
FDA patariamojo komiteto narių atsistatydinimas
Per pirmąją savaitę po FDA patvirtinimo atsistatydino trys Periferinės ir centrinės nervų sistemos vaistų patariamojo komiteto nariai. Tai buvo Harvardo medicinos mokyklos daktaras Aaronas Kesselheimas (Aaron Kesselheim), neurologai Davidas Knopmanas iš Mayo klinikos Minesotoje ir Joelis Perlmutteris iš Vašingtono universiteto Sent Luise.
Atsistatydinimo laiške A. Kesselheimas FDA žingsnį pavadino "tikriausiai blogiausiu sprendimu dėl vaistų patvirtinimo naujausioje JAV istorijoje". Kesselheimas taip pat rašė "Tweeter": "Pagreitintas patvirtinimas neturėtų būti atsarginis variantas, kuriuo naudojatės, kai klinikinių tyrimų duomenys nėra pakankamai geri įprastam patvirtinimui".
Accelerated Approval is not supposed to be the backup that you use when your clinical trial data are not good enough for regular approval.
— Aaron Kesselheim (@akesselheim) June 7, 2021
Knopmanas (Knopman) ir Perlmutteris (Perlmutter) komentarą paskelbė žurnale "Neurology" 2021 m. liepos mėn. Jie rašė, kad "klinikinė nauda sudarė maždaug 3 mėnesių trukmės vėlavimą mažėti per metus", turėdami omenyje "Biogen" 2019 m. spalio mėn. pranešime spaudai pateiktus "teigiamus rezultatus". Jie teigė: "Sujungus 2 tyrimų rezultatus nenustatyta statistiškai reikšmingos klinikinės didelės adukanumabo dozės naudos".
Šalutinis poveikis ir saugumo problemos
Yra žinoma, kad smegenų pabrinkimas ir kraujavimas iš smegenų yra galimi šalutiniai "Aduhelm" poveikiai. Prieš patvirtinant FDA, Biogen atliko du 3 fazės tyrimus. 3 fazės tyrimai pradėti 2015 m. rugpjūtį, tačiau po trejų su puse metų, 2019 m. kovą, "Biogen" nutraukė abu tyrimus. Sprendimas buvo priimtas remiantis nepriklausomo duomenų stebėsenos komiteto atlikta beprasmiškumo analize, kuri parodė, kad baigus tyrimus vargu ar bus pasiektas pagrindinis galutinis tikslas. Tai reiškia, kad tyrimai greičiausiai neįrodė vaisto veiksmingumo lėtinant Alzheimerio liga sergančių pacientų pažinimo funkcijų mažėjimą.
Nutrauktų 3 fazės tyrimų saugumo duomenys buvo paskelbti žurnale "JAMA Neurology" 2021 m. lapkričio mėn. Tyrime daugiausia dėmesio buvo skiriama su amiloidu susijusiems vaizdo pakitimams (ARIA), kurie gali sukelti galvos skausmą, sumišimą, galvos svaigimą, pykinimą, kraujavimą į smegenis ir patinimą.
Duomenys parodė, kad 425 iš 1029 pacientų, arba 41 proc. pacientų, gavusių didelę vaisto dozę - dozę, kurią vėliau patvirtino FDA - patyrė smegenų pabrinkimą arba kraujavimą. Be to, 64 pacientai dėl smegenų pabrinkimo ar kraujavimo turėjo nutraukti dalyvavimą tyrimuose.
2021 m. rugsėjį, praėjus keliems mėnesiams po vaisto patvirtinimo, Kanadoje gyvenusiai 75 metų moteriai, klinikinių tyrimų pacientei, po vaisto infuzijų pasireiškė smegenų pabrinkimas ir po kelių dienų ji mirė.
Amiloido beta hipotezė
Teorija, kuria grindžiama "Aduhelm" ir daugybė kitų eksperimentinių vaistų nuo Alzheimerio ligos, yra hipotezė, kad per didelis amiloido-beta apnašų kiekis smegenyse sutrikdo normalią smegenų komunikaciją ir taip sukelia pažinimo funkcijų pablogėjimą.
Iš tikrųjų liga pavadinta vokiečių patologo Aloiso Alzheimerio, kuris paciento smegenyse aptiko amiloido-beta apnašų, vardu.
Tačiau ši hipotezė nėra įrodyta ir pati savaime yra prieštaringa.
Trys ketvirtadaliai FDA finansavimo - iš vaistų gamintojų
Valdžios priežiūros projektas (POGO) yra nepartinė nepriklausoma priežiūros organizacija, tirianti ir atskleidžianti švaistymą, korupciją, piktnaudžiavimą valdžia ir atvejus, kai valdžia nesugeba tarnauti visuomenei arba nutildo tuos, kurie praneša apie pažeidimus.
Dviejų dalių POGO tyrimo ataskaitoje išsamiai atskleidžiama, kad FDA yra jos reguliuojamos pramonės kišenėje. Ataskaitoje teigiama, kad "agentūra, kurios pareigos - užtikrinti, kad Jungtinėse Valstijose parduodami receptiniai vaistai būtų saugūs ir veiksmingi, beveik tris ketvirtadalius savo veiklos finansavimo gauna iš vaistų gamintojų".
Ataskaitos II dalyje atskleidžiama, kad pacientų "balsą" FDA posėdžiuose taip pat dažnai finansuoja vaistų kompanijos.
Europos ir Japonijos agentūros atmeta "Aduhelm
2020 m. spalio mėn. bendrovė "Biogen" pateikė paraišką dėl leidimo prekiauti Europoje. 2021 m. gruodį, praėjus šešiems mėnesiams po to, kai FDA pagreitintai patvirtino "Aduhelm", Europos vaistų agentūra atmetė "Biogen" paraišką prekiauti "Aduhelm" Europoje.
EMA laikėsi nuomonės, kad "Aduhelm nauda neatsveria jo keliamos rizikos". Pirma, klinikinių tyrimų rezultatai "buvo prieštaringi ir neįtikinamai rodė, kad "Aduhelm" veiksmingai gydo suaugusiuosius, sergančius ankstyvos stadijos Alzheimerio liga". Be to, kai kurių klinikinių tyrimų pacientų smegenų skenavimas rodo smegenų pabrinkimą ar kraujavimą, o tai kelia didelį susirūpinimą dėl saugumo.
Tą patį mėnesį Japonijos naujų vaistų komitetas taip pat atmetė "Biogen" paraišką ir paprašė pateikti daugiau duomenų, įrodančių vaisto veiksmingumą.
Daugiau skaitykite čia...
Nuotrauka viršuje: Vaisto "Aduhelm" buteliukas ir pakuotė parodyta 2021 m. birželio 7 d. (Biogen via AP)
...kadangi jau perskaitėte šį straipsnį iki pabaigos, prašome Jus prisidėti prie šio darbo. Skaitykite „Paranormal.lt“ ir toliau, skirdami kad ir nedidelę paramos sumą. Paremti galite Paypal arba SMS. Kaip tai padaryti? Iš anksto dėkojame už paramą! Nepamirškite pasidalinti patikusiais tekstais su savo draugais ir pažįstamais.
Susijusios naujienos:
Komentarai su keiksmažodžiais bus šalinami automatiškai, be atsiprašymo.
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau

