- 2017-07-02
- 0.0 Reitingas
- 2960 Peržiūros
- Komentarai
Kas atsitinka, kai dantis imame valyti su pastomis, kurios chemiškai naikina burnoje gyvenančias bakterijas? Apie tai suprasite įveikę šį ne medikui vietomis nelabai suprantamą straipsnį. Tačiau paplušėti ties juo tikrai verta, jau vien tam, kad nusikrapštyti „makaronus“ nuo ausų, kabinamus per masines informavimo priemones.
Paskutinį pusę amžiaus laikotarpį vidutinė žmogaus gyvenimo trukmė išsivysčiusiose šalyse padidėjo 20-25 metais. Priežasčių tam daug, tačiau viena iš svarbesnių – antibiotikų naudojimas ir higieninių priemonių vartojimas. Antibiotikų pagalba gydytojai išmoko lengvai susitvarkyti su patologiniais mikrobais, ateinančiais atlikti savo darbą, kai žmogus nesilaiko gamtos dėsningumų. Tokios būsenos gydytojams anksčiau buvo nepavaldžios, tačiau dėka sanitarinių-epidemiologinių priemonių ir antibiotikų išsivysčiusiose šalyse jas šiek tiek pavyko suvaldyti ir dėl to gyvenimo trukmė išaugo. Jei dvidešimto amžiaus pradžioje daug žmonių gyvybių nusinešė „kaltininkas“ mikrobas Diplococcus pneumoniae (nuo 1974 m. pervadintas į Streptococcus pneumoniae), šiandien šio susirgimo priežastimi jau kaltinami sąlygiškai patologiniai žmogaus organizmo natūralios mikrofloros mikrobai.
Suvokti ir teisingai elgtis tokiose situacijose medicinos mokslas kol kas taip ir neišmoko, todėl ir žmonių kiekis, kamuojamas šių negandų, net ir išsivysčiusiose šalyse ne tik nesumažėjo, bet ir žymiai išaugo – faktiškai šias problemas turi beveik visi civilizuoti gyventojai. Daugiau kaip 60% mūsų laikmečio gyventojų gyvenimo eigoje susiduria su periodantitu (jungiamojo audinio, laikančio dantį kaulinėje alveolėje, uždegimas), daugiau kaip 40% - kamuoja chroniškas gastritas, vis dar siejamas su bakterija Helicobacter pylori, 20% – odos-gleivinės kandidozė. Šių ir daugelio kitų problemų „sukėlėjai“ dešimtmečius gyvena žmogaus organizme bendradarbiaudami, tačiau vieną gražią dieną tampa infekcinio uždegiminio proceso „priežastimi“, dažnai chroniško. Kadangi tokie mikrobai net ir aktyvuotoje formoje yra mažai patogeniški, tai jų „sukelti“ endogeniniai susirgimai ar autoinfekcijos, nei aštrūs, nei chroniški, nepasibaigia mirtimi, bet labai žymiai pagadina gyvenimo kokybę. Žodžiu, vaikšto žmogeliai tokie pusiau lavonai – kosintys, apsisnargliavę, apsispuogavę, karščiuojantys, viduriuojantys, kraujuojantys ir prakaituojantys. Be to, autoinfekcijos gali išprovokuoti tokias patologines būsenas kaip aterosklerozė, alergija ir autoimuniniai susirgimai (pvz., reumatoidinis artritas).
Mokslinėje literatūroje vis dažniau pasirodo duomenų, kad pagrindinė autoinfekcijų priežastis slypi žmogaus organizmo imuninės sistemos tolerantiškumo jo nuolatinei mikroflorai praradime. Jei apie šį tolerantiškumą buvo žinoma seniai, tai supratimas apie šio „pakantumo“ formavimosi mechanizmus pradėjo aiškėti tik labai neseniai – po to, kai Charles Janeway atrado taip vadinamus patogeno atpažinimo receptorius (pathogen recognition receptors arba pattern recognition receptors), atvedusius imunologiją į naują vystymosi etapą. Visų pirma paaiškėjo, kad tie receptoriai specifiškai kontroliuoja visus organizmo imuninius procesus, ir antra, kad imuninė sistema seka ne tik organizmo organų ir audinių ląstelinę sudėtį, bet ir jų mikroflorą. Tokiu būdu atsirado galimybė išanalizuoti endogeninių infekcijų atsiradimo priežastis ir ieškoti būdų kaip jų išvengti [1].
Bekonfliktinis gyvenimas drauge
Mūsų organizme gyvena didžiulis kiekis įvairiausių mikrobų. Jie gyvena gleivinių paviršiuje, ant odos, audiniuose ir organuose, o daugiausia jų susikoncentravę virškinimo trakte – 1014 mikroorganizmų iš daugiau kaip tūkstančio rūšių įvairovės (palyginimui – mūsų organizmas susideda iš 1013 ląstelių) [2]. Į organizmą jie dažniausiai pakliūva su maistu, tačiau „prisiregistruoti“ nuolatiniam gyvenimui pavyksta nedaugeliui. Imuninė sistema, apsiginklavusi visa eile antimikrobinių faktorių (tame tarpe ir specifiniu sekreciniu imunoglobulinu A), jei ir neužmuša „nekviestų svečių“, tai bent atima jiems adhezijos (nuo angl. adhesion – prisijungimas, sulipimas) ir dauginimosi galimybę gleivėse ant epitelio. Tik nedideliam mikroorganizmų kiekiui pavyksta prasiskverbti į epitelinį sluoksnį (tuo pačiu aktyvuojasi visos imunokompetentiškos limfinio subepitelinio audinio ląstelės), didžioji jų dauguma praeina per žarnyną ir pasišalina iš organizmo.
Žinoma, tokia organizmo imuninės sistemos reakcija į praeinančią (tranzitinę) mikroflorą svarbi, jos sudėtyje gali būti ne tik nekenksmingi, bet ir patologiniai mikrobai. Būtent dėl to minimali užsikrėtimo dozė net ir labai patogeniškais mikrobais yra pakankamai didelė. Ne mažiau svarbu yra tai, kad tranzitinė mikroflora pastoviai sukuria plataus spektro antigeninę apkrovą imuninei sistemai, taip palaikydama jos aktyvią darbinę būseną, garantuojančią adekvatų atsaką į silpnus ir stiprius imunogenus. Tai patvirtina bandymai su bemikrobiais gyvūnais ir alerginių reakcijų didėjimo tendencijos nebuvimas kaimo vietovėse, skirtingai nuo miestų, kuriuose higienos lygis yra aukštas. Remiantis būtent šiais duomenimis yra sukurta alerginių reakcijų ir endogeninių uždegimų augimo priežasčių tarp miesto gyventojų higieninė teorija [2].
Didelę dalį žmogaus pastovios mikrofloros sudaro aktyviai besidauginantys mikroorganizmai, kuriems žmoguje susiformavo taip vadinama oralinė tolerancija. Pakliuvus į organizmą tokiems mikrobams imuninė sistema į juos nereaguoja – nėra aktyvuojamos nei epitelio ląstelės, nei natūralaus ar adaptacinio imuniteto ląstelės [2]. Oralinės tolerancijos pagrindą sudaro imunokompetentiškų ląstelių aktyvavimo reakcijų ir citokinų gamybos jose slopinimas, tai pasiekiama patogenus atpažįstančių receptorių supresijos būdu – daugiausiai TLR šeimos signalinių baltymų, kurie „sėdi“ nat ląstelių paviršiaus ir vidinių struktūrų ir pirmieji praneša imuninei sistemai apie patogeno įsiveržimą. tokio aktyvumo palaikyme pagrindinį vaidmenį vaidina trys ląstelių tipai: T-reguliuojančios ląstelės (CD4+CD25+-limfocitai), kontroliuojantys kaip centrinę (savo audiniam ir organam), taip ir periferinę (oralinę) toleranciją; epitelinės ląstelės, tiesiogiai ir pastoviai kontaktuojančios su mikroflora; dendritinės ląstelės, kurių aktyvavimas nulemia adaptacinio imuniteto reakcijų vystymąsi [3, 4].
Oralinis tolerancijos susidarymo ir palaikymo mechanizmai kol kas nėra išsiaiškinti, tačiau neginčijamai aišku tik viena – jie formuojasi pirmais vaiko gyvenimo mėnesiais, todėl ir pastovios mikrofloros sudėtis kiekvienam žmogui yra skirtinga. Be to, aišku tai, kad oralinei tolerancijai formuotis būtinas daugkartinis antigeno mažų dozių įvedimas į organizmą, ir kas įdomiausia – ji formuojasi visai mikroorganizmo molekulinių struktūrų sumai. Jei būtų kitaip ir šis „pakantumas“ susidarytų kiekvienai mikroorganizmo struktūrai, tai imuninė sistema nustotų atpažinti visus tuos mikrobus, kurie savo sudėtyje turi tokias pačias molekulines struktūras (taip pat ir iš tranzitinės mikrofloros tarpo).
Žmogaus nuosavos mikrofloros augimo ir dauginimosi nestabdo ir skaitlingi nespecifiniai antimikrobiniai faktoriai (defenzinai, komplemento baltymai, lizocimas ir kt.), kuriuos pastoviai gamina žarnyno epitelis. Visos šios priemonės nukreiptos prieš tranzitinę mikroflorą, kuriai apsigyventi ir daugintis taip pat trukdo dar ir pastovioji, nuosavoji mikroflora, kuri kolonizuoja visus specifinius jai adhezinius gleivių, išskiriamų epitelinio sluoksnio taurinių ląstelių, plotus. Tačiau tuo nuosavos mikrofloros teigiamas vaidmuo neapsiriboja – ji gamina didelę dalį vitaminų, aktyvuoja žarnyno peristaltiką, kas yra būtina jo funkcionavimui [2]. Šie mikroorganizmai išlieka mums naudingi net ir po savo natūralios mirties (kas vyksta masiškai nuolat) – atlieka enterosorbento vaidmenį, išvesdami toksines medžiagas iš organizmo. Tačiau taip vyksta tik sveiko žmogaus organizme, kuris gyvena santarvėje su savo mikroflora. Kas gi turi įvykti, kad ši taika būtų suardyta ir iki tol nekensmingi mikrobai imtų konfliktuoti su žmogaus imunine sistema, taptų uždegiminio proceso kaltininkais?
Už „pakantumo“ ribos
Kaip žinoma, bet kuriame konflikte kalti abu – mūsų atveju ir organizmas, ir jo nuosava mikroflora, kuri 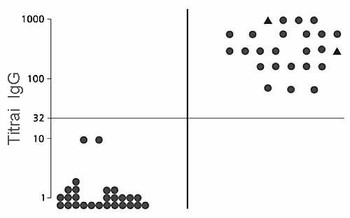 yra labai nevienalytė. Todėl įvairių mikrobų dalyvavimas uždegiminiuose procesuose nevienodas ir nusakomas tikriausiai jų savybėmis ir jų koevoliucijos su makroorganizmu trukme. Prie sąlyginai patogeniškų mikrobų priskiriami tie, kurie dažniausiai sukelia autoinfekcijas. Tačiau retkarčiais tame dalyvauti gali, atrodo, ir visai nekalti nuosavos mikrofloros atstovai – pavyzdžiui laktobakterijos, kurios visada buvo laikomos būtinais žmogui simbiontais [5]. Šiuo metu yra išaiškinti ne tik dešimtys bakterijų iš nuosavos mikrofloros tarpo, kaltų dėl autonfekcijos susidarymo, bet nustatyta ir jų dalyvavimo tikimybė formuojantis kokiam nors susirgimui (pavyzdžiui parodontozei).
yra labai nevienalytė. Todėl įvairių mikrobų dalyvavimas uždegiminiuose procesuose nevienodas ir nusakomas tikriausiai jų savybėmis ir jų koevoliucijos su makroorganizmu trukme. Prie sąlyginai patogeniškų mikrobų priskiriami tie, kurie dažniausiai sukelia autoinfekcijas. Tačiau retkarčiais tame dalyvauti gali, atrodo, ir visai nekalti nuosavos mikrofloros atstovai – pavyzdžiui laktobakterijos, kurios visada buvo laikomos būtinais žmogui simbiontais [5]. Šiuo metu yra išaiškinti ne tik dešimtys bakterijų iš nuosavos mikrofloros tarpo, kaltų dėl autonfekcijos susidarymo, bet nustatyta ir jų dalyvavimo tikimybė formuojantis kokiam nors susirgimui (pavyzdžiui parodontozei).
Antikūnų (IgG) antigenams Chlamydia trachomatis titrai sveikų pacienčių kraujo serume, pas kurias buvo rastos chlamidijos, prieš (kairėje) ir po gydymo antibiotikais. Antikūnų lygis buvo nustatomas imunofermentinės analizės metodu panaudojant test-sistemas „Imunokomb“ (firmos „Orgenics“). Duotoje test-sistemoje diagnostiškai reikšmingais laikomi titrai 1:32 ir aukštesni. Trikampiais pažymėti pacienčių, kurioms kraujo ėmimo momentu buvo išryškėję urogenitalinio uždegiminio proceso požymiai, analizės rezultatai.
Akivaizdu, kad endogeninių infekcijų susidarymui svarbus vaidmuo tenka įvairių stresinių faktorių poveikis organizmui ir jo mikroflorai. Jau pakankamai seniai įžymusis patologas I.V.Davydovskis, o paskui jį sekęs ir infekcionistas A.F.Bilibinas pažymėjo, kad šių infekcijų augimas susijęs su plačiu antibiotikų naudojimu. Galima nurodyti pakankamai daug pavyzdžių, kurie šį teiginį patvirtina: labiausiai paplitęs iš jų, o todėl visiems geriausiai žinomas – tai kandidozė po antibiotikų pavartojimo. Kitas pavyzdys susijęs su chlamidijomis (konkrečiai su Chlamydia trachomatis) – bakterijomis, sukeliančiomis pavojingus moteriai urogenitalinius uždegiminius susirgimus. Praeito šimtmečio pabaigoje daugelis gydytojų ėmė skirti antibiotikus visiems šio mikroorganizmo nešiotojams, tai yra moterims, kurių tepinėliuose buvo rastos chlamidijos, nors susirgimo požymių nebuvo. Ištyrus šias moteris buvo nustatyta, kad iki antibiotikų panaudojimo pas daugelį iš jų kraujyje nebuvo antikūnų prieš šias bakterijas, o štai po antibiotikų terapijos antikūnų titrai tapo žymūs, kas rodė esant uždegiminį procesą. Pažymėtina tai, kad atsikratyti chlamidijų toms pacientėms taip ir nepavyko.
Nors daugeliui mokslininkų jau tapo aišku, kad endogeninių infekcijų atsiradimas susijęs su oralinės tolerancijos pastovios mikrofloros mikroorganizmams, sukėlusiems šį susirgimą, praradimu [6-8], molekuliniai-ląsteliniai šio reiškinio mechanizmai iki šiol yra nenustatyti. Mokslininkų nuomone, pačia paprasčiausia tolerantiškumo bakterijoms praradimo priežastimi gali būti susidarymas ant mikroorganizmo paviršiaus naujų, keičiančių mikroorganizmo fenotipą, struktūrų [9]. Tokiomis struktūromis gali būti taip vadinami šiluminio šoko baltymai (HSP), atrasti tik prieš keturis dešimtmečius. Vėliau paaiškėjo, kad šie baltymai imami sintetinti dideliais kiekiais ne tik kaip atsakas į pakilusią temperatūrą, bet ir kitose stresinėse organizmui situacijose – šąlant, badaujant, keičiantis aplinkos slėgiui, esant chirurginei intervencijai ir t.t., o svarbiausia – įvairių cheminių medžiagų, tame tarpe antibiotikų ir priešuždegiminių vaistų, poveikyje.
Visi stres-baltymai, kaip dažnai dabar juos vadina, dalinami į penkias pagrindines grupes, priklausomai nuo jų molekulinės masės. Geriausiai išstudijuoti iš jų yra HSP60 ir HSP70 (tai yra jų molekulinė masė yra atitinkamai 60 ir 70 kDa). Visi jie vaidina šaperonų vaidmenį, tai yra seka, kad būtų teisingas tretinės baltymų struktūros sukūrimas ir sudarymas ląstelėje. Todėl HSP yra bet kokių (ir eukariotinių ir prokariotinių) ląstelių citoplazmoje, bet mažais kiekiais. Esant stresui jų kiekis labai stipriai išauga ir siekia 20% nuo visos ląstelės baltymų masės, kas padeda ląstelei pergyventi ekstremalią situaciją [10] (garantuoja gerą ląstelės baltyminio citoskeleto sudėtį, kad ląstelės galėtų pereiti į anabiozinę būseną – užsikonservuoti ir pergyventi situaciją).
Ilgai buvo manoma, kad HSP yra ląstelės viduje, net ir tada, kai juos aptikdavo kraujo serume ar kultūrinėje terpėje, manė, kad tai surišta su ląstelių suirimu. Tik neseniai pavyko įrodyti, kad didžiausias HSP kiekis susidaro ant ląstelės paviršiaus ir pakliūna nuo jos į aplinką. Daugelio tyrinėjimų įrodyta, kad po įvairių antibiotikų ir kitų antibakterinių preparatų poveikio mikroorganizmų paviršiuje HSP kiekis labai išauga [11]. Be to, nustatyta, kad stresiniai baltymai yra labai imunogeniški. Pirmieji į juos sureaguoja atpažįstantys receptoriai TLR2, TLR4 и CD14, kurie, aktyvuodami dendritines ląsteles, paleidžia adaptacinį imunitetą su atitinkamų antikūnų sinteze ir specifinių T-limfocitų susidarymu [11].
Iki šiol daugelis tyrinėtojų nesuvokia, kodėl imuninės sistemos tolerantiškumas netaikomas endogeniniams stres-baltymams. Tai dėsninga, nes imuninė sistema lygiai taip pat nepakanti ir daugeliui embrioninių baltymų, liekančių suaugusiame organizme mažais kiekiais. Centrinis tolerantiškumas niekada nebūna visiškas, nes to organizmui net ir nereikia. Norint tai suprasti, reikia prisiminti vieną iš pagrindinių imunologijos, o ir apskritai visos biologijos, dėsnių – bet kurio poveikio dozės prioritetiškumo (tam, kad būtų gautas efektas) dėsnį. Ryšium su tuo analizuojant visus procesus organizme svarbu įvertinti bet kurios veikimo pradžios ne tik kokybinius, bet ir kiekybinius parametrus. Tai tinka kaip dirgikliui, taip ir reakcijai į tą dirgiklį. Pavyzdžiui silpni poveikiai dėl homestazės mechanizmų niveliuojasi ir neinicijuoja organizmui esminių procesų [1].
Sveiko žmogaus organizme paprastai yra minimalus šiluminio šoko baltymų kiekis, o ir antikūnai į juos, jei kraujo serume ir išryškėja, tai jų titrai nežymūs. Tačiau prie bet kokio uždegiminio proceso vaizdas stipriai keičiasi, ir antikūnų šiluminio šoko baltymams HSP titras kraujo serume labai išauga [12]. Pavyzdžiui, aukšti antikūnų titrai Chlamydia trachomatis šiluminio šoko baltymams HSP gali būti ne tik pas moteris, kurioms chlamidijozės požymiai aiškūs, bet ir pas kai kurias sveikas moteris, kas liudija apie imuninės sistemos tolerantiškumo chlamidijoms praradimą ir urogenitalinės infekcijos formavimosi pradžią.
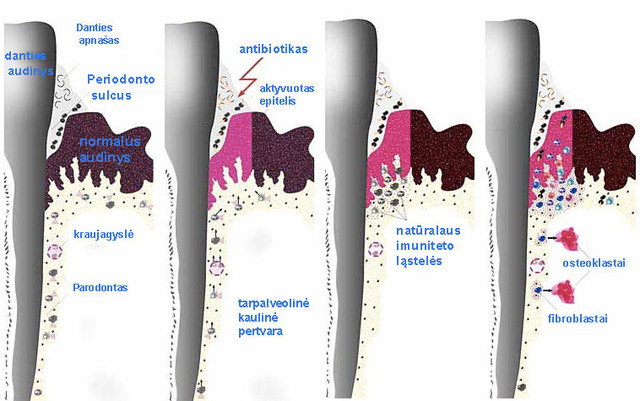
Visi šie pateikti faktai yra pagrindas teigti, kad organizmo tolerantiškumo jo pastoviai mikroflorai praradimas labiausiai vyksta dėl šiluminio šoko baltymų mikroorganizmuose staigaus padidėjimo, kurį sukelia koks nors stresogeninis poveikis. Parodysim schematiškai autoinfekcijos patogenezės ypatumus parodontozės atveju (tai vienas iš labiausiai paplitusių susirgimų).
Įvairiausi mikroorganizmai apsigyvena žmogaus burnoje pirmomis valandomis po jo gimimo ir lydi jį visą gyvenimą. Daugelis iš jų tai bakterijos iš pastovios mikrofloros tarpo, kurios mėgsta daugintis taip vadinamame dantų apnaše. Šis kietas darinys iš baltymų, polisacharidų, lipidų ir kai kurių neorganinių medžiagų (kalcio, fosfatų, magnio, kalio, natrio ir kt.) ima kauptis ant danties emalio iškart po dantų valymo, suteikdamas ir stalą, ir pastogę daugeliui bakterijų.
Parodontozės vystymosi schemaa – sveiko žmogaus parodonto audinyje, kurio pagrindą sudaro fibroblastai, išmėtytos natūralaus imuniteto ląstelės. Net ir neaktyvioje būsenoje jos pastoviai gamina nedidelį kiekį citokinų. Tai sudaro galimybę imuninei sistemai efektyviai naikinti nuolat įsibraunančius į organizmą svetimus mikroorganizmus, jei jų skaičius neperžengia tam tikro lygio.
b – antibiotikų (ar kitų neigiamų faktorių) įtakoje mikroorganizmuose, esančiuose mikrobiniame apnaše, keliskart padidėja šiluminio šoko baltymų kiekis. Dėl to keičiasi mikrobinės ląstelės fenotipas ir epitelinių ląstelių patogeną atpažįstantys receptoriai ima atpažinti jas jau kaip svetimas, tai yra tolerancija dingsta. Epitelinės ląstelės aktyvuojasi ir ima intensyviai gaminti chemokinus (mažos molekulinės masės baltymus, tarpininkaujančius uždegiminiame procese).
c – chemokinai pritraukia į šį regioną didesnį skaičių natūralaus imuniteto ląstelių iš supančio audinio, o svarbiausia iš kraujagyslės spindžio. Dėka to šiame plote susidaro kritinė prouždegiminių citokinų koncentracija ir taip formuojasi pirminis endogeninio uždegimo židinys su atitinkamais audinio pažeidimais.
d – susidaro palankios sąlygos tokiai su pakitusiu fenotipu mikroflorai prasiskverbti į uždegimo židinį. Be to, per patogeno atpažinimo receptorius aktyvuojami ne tik natūralaus imuniteto ląstelės, bet ir fibroblastai. Uždegimas stiprėja ir plečiasi. Aktyvuoti fibroblastai gamina rinkinį citokinų, kurie stimuliuoja epitelinių ląstelių augimo faktorius. Tai sukelia, iš vienos pusės, stiprią epitelio proliferaciją, o iš kitos – makrofagų transformavimo į osteoklastus, kurie suardo tarpkaulinę alveolinę pertvarėlę (paveiksle neparodyta), aktyvavimą.
Ilgalaikio antibiotikų ar kitų antibakterinių preparatų naudojimo burnos ertmėje rezultate ant bakterijų paviršiaus, kurios gyvena danties apnaše, pasirodo daug šiluminio šoko baltymų. Jeigu apnašas nepašalinamas, pasileidžia imuninio atsako reakcijos. Patogeno atpažinimo receptoriai TLR2, TLR4 ir CD14 atpažįsta šias bakterijas kaip svetimas ir paleidžia reakcijų kaskadą, aktyvuojančių epitelinės ląstelės chemokinų ir kitų baltymų branduolinę transkripciją. Aktyvavusis šioms ląstelėms padidėja gleivių gamyba, o tai skatina daugintis pastovios mikrofloros mikrobus, kurie savo ruožtu gamina priešmikrobinius faktorius, palaikančius pasikeitusiose bakterijose HSP susidarymą. Taip susidaro užburtas ratas. Iš vienos pusės, chemokinų sintezė galiausiai sukelia natūralaus imuniteto ląstelių po epiteliniu sluoksniu koncentracijos ir pirminio uždegimo židinio susidarymą. Šiame etape vyksta jungiamojo audinio ardymas ir fibroblastų žuvimas, kurie sukelia audinio susiraukšlėjimą bei kišenės susidarymą dantenoje, o ši užsipildo aktyvuotais mikrobais. Po to prie proceso prisijungia adaptacinis imunitetas ir jame dalyvauja jau dendritinės ląstelės, į židinį veržiasi aktyvuoti T-limfocitai, ir vėl išauga prouždegiminių citokinų sintezė, padedanti didėti uždegimui.
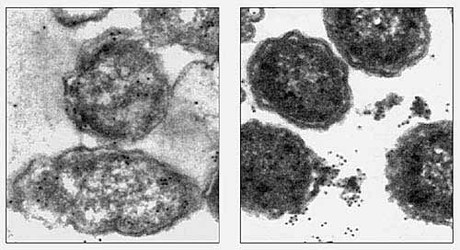
Bakterijos Actinobacillus actinomycetemcomitans, gyvenančios burnoje ir sukeliančios periodantitą elektroninės mikrofotografijos iki (iš kairės) ir po stresinio poveikio (30 minučių 43°С temperatūra) [16]. Matosi, kad pakliuvusiose į stresą bakterinėse ląstelėse šiluminio šoko baltymų (GroEL), kurie buvo atpažinti imunofermentinio dažymo pagalba, sintezė žymiai sustiprėjo.
Svarbu suprasti, kad visi „kariniai“ veiksmai būtų pateisinami, jeigu jie būtų nukreipti į tikrą „priešą“, o ne į aktyvuotus pastovios mikrofloros mikroorganizmus, kurie, skirtingai nuo patogeninių, neturi arba turi labai mažai toksinių medžiagų ir žmogui yra nekenksmingi, o dažnai netgi naudingi. Neseniai tokia organizmo hiperreakcija buvo pavadinta destrukcine (skirtingai nuo produktyvios, kuri mus gina nuo patogeninių mikrobų [13]. Destrukcinė imuninė reakcija gali tapti ne tik chroniškų uždegiminių procesų, bet ir kitų žmogaus sveikatos problemų priežastimi.
Pražūtinga įtaka
Praeito amžiaus pabaigoje tyrinėtojai atkreipė dėmesį į tai, kad kai kuriems pacientams kylančios endogeninės infekcijos (parodontozė, chlamidijozė ir kt.) lydimos kitų uždegiminių susirgimų (aterosklerozės, reumatoidinio artrito, kai kurių diabeto formų, įvairių alergijų, bronchinės astmos) susidarymo arba paaštrėjimo. Dabartiniu metu, kai yra išanalizuotas didelis kiekis autoinfekcijų eigų, jų įtaka kitų patologijų susidarymui jau nekelia abejonių. Maža to, nustatyta, kad šių ligų vystymasis susijęs ne su kokia nors konkrečia autoinfekcija, o su bet kuria iš jų [14]. Kuo pasireiškia ši įtaka?
Kaip jau minėjome, bet kurio susirgimo klinikiniame pasireiškime svarbiausią vaidmenį vaidina patogeninio faktoriaus ar poveikio kiekis. Žinome, kad praktiškai pas visus sveikus žmones galima aptikti vidutinius, o pas kai kuriuos ir aukštus antikūnų (IgE) kokiam nors alergenui lygius, antikūnus vienam ar kitam organizmo audinio antigenui ir netgi nedidelį kiekį specifinių tam audiniui T-limfocitų. Senyvame ir netgi vidutiniame amžiuje paprastai nustatomas kraujagyslių elastingumo sumažėjimas dėl ant jų nusėdusio cholesterolio ir kalcio (be plokštelių susidarymo kraujagyslėse, kurios sudaro pagrindinį pavojų organizmui). Veikiausiai, šie ir kiti panašūs sutrikimai vystosi į patologiją tik tuo atveju, jeigu jie yra labai išreikšti arba sutrinka homeostatiniai jų kompensavimo mechanizmai, ir tai gali būti stebima esant visai eilei imunodeficitinių būsenų.
Esant silpniems ir vidutiniams vienų ar kitų organizmo parametrų patologiniams pokyčiams perėjimui nuo latentinės būsenos prie susirgimo išreikšto klinikinio vaizdo daugeliu atvejų būtinas papildomas stimulas.
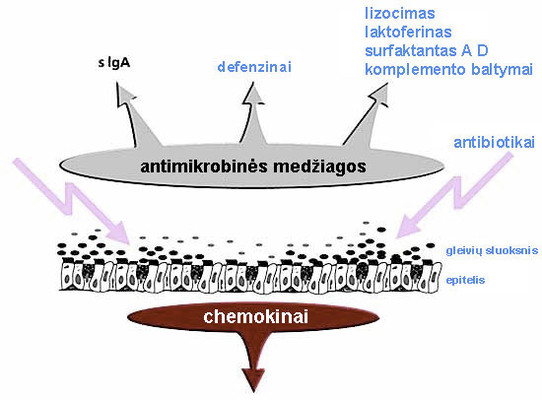
Endogeninio uždegiminio proceso stresinio poveikio į normalios mikrofloros mikroorganizmų vystymosi pradžios schema. Ant epitelio gleivių sluoksnio yra normalios mikrofloros mikroorganizmai (pavaizduoti pilkais ovalais). Antibiotikų poveikis (parodytas rodyklėmis) iššaukia intesyvią stres-baltymų (HSP) sintezę ant mikroorganizmų paviršiaus (juodi ovalai). Jie aktyvuoja patogeno atpažinimo receptorius epitelinėse ląstelėse, kurios pradeda gaminti įvairias antimikrobines medžiagas (ir tai palaiko HSP susidarymą mikroorganizmuose), chemokinus, pritraukiančius į šią sritį judrias natūralaus imuniteto ląsteles, taip pat ir prouždegiminius citokinus. Taip įtakojus HSP ir kitiems aktyvuotų mikroorganizmų antigenams, prasideda destrukcinė uždegiminė reakcija.
Aterosklerozės, reumatoidinio artrito ir kitų aukščiau išvardintų susirgimų pamate dėl stipraus lokalaus prouždegiminių citokinų susidarymo vyksta destrukcinio uždegiminio proceso vystymasis. Paskutinius 15 metų daugelis tyrinėtojų esant visiems šiems susirgimams patologiniame židinyje randa mikroorganizmus – endogeninių infekcijų sukėlėjus. Endogeninės infekcijos atveju ant nuosavos normalios mikrofloros mikroorganizmo paviršiaus susidaro daugybė HSP, o tai padidina jo adhezines savybes, tai yra padeda jam prisitvirtinti prie šeimininko ląstelių. Dėl natūralaus imuniteto ląstelių ir patogeno atpažinimo receptorių TLR2 ir TLR4 migracijos į šią sritį, pasileidžia uždegiminis procesas, bei iš šių ląstelių yra išmetami prouždegiminiai citokinai. To neįvyks, jei ten pat prisitvirtins tokia pati mikrobinė ląstelė, tačiau be padidinto HSP kiekio, nes organizmas yra jai tolerantiškas [15]. Jeigu be to ten pat dar yra ir latentiniai nukrypimai, specifiški duotam uždegiminiam procesui, tuomet visa tai tampa pakankamu startiniu stimulu patogenetinių mechanizmų paleidimui ir patologinio proceso klinikinių pasireiškimų vystymuisi, ar tai būtų aterosklerotinės plokštelės darinys ar reumatoidinio artrito vystymasis.
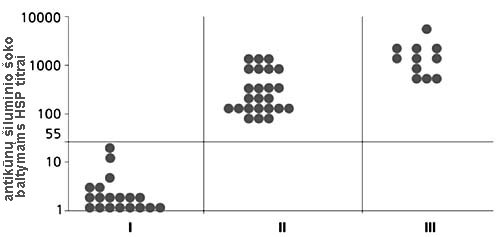
Antikūnų šiluminio šoko baltymams (HSP) Chlamydia trachomatis titrai pacienčių, kurioms buvo diagnostiškai išaiškinti žymūs antikūnų šios bakterijos antigenams lygiai, kraujo serume (II – moterys be susirgimo požymių, III – su klinikiniu uždegiminio proceso pasireiškimu). Kontrolei parodyti (I) antikūnų HSP titrų lygiai sveikų moterų, pas kurias nebuvo aptikta antikūnų prieš chlamidijas. Imunofermentinė analizė buvo atlikta panaudojant Medac firmos test-sistemą. Duotoje test-sistemoje diagnostiškai reikšmingi titrai – 1:50 ir aukštesni.
Prognozuoti alerginių susirgimų atsiradimą pas sveikus asmenis padidėjus pas juos IgE alergenams kiekiui arba pradėjus vystytis aterosklerozei, kai sumažėja kraujagyslių elastingumas buvo bandyta ne kartą. Iš tikro, ir pirmu, ir antru atveju atitinkami koreliaciniai ryšiai buvo išaiškinti, bet profilaktinės medicinos praktinių uždavinių sprendimui toks koreliacijos lygis buvo aiškiai nepakankamas. Tuo pačiu šiandien nustatyta, kad endogeninių infekcijų organizme buvimas su dideliu patikimumu rodo padidėjusią tokių susirgimų vystymosi riziką. Iš kitos pusės, prie visų uždegiminių procesų kraujo serume žymiai išauga HSP kiekis. Todėl tampa akivaizdu, kad šių baltymų kiekio kraujo serume nustatymas taps iš principo daug patikimesniu šių visų susirgimų profilaktikos prognozavimo kriterijumi.
Profilaktika ir gydymas
Mąstant apie endogeninių infekcijų profilaktiką, reiktų pirmiausia galvoti apie plataus spektro antibiotikų vartojimo sumažinimą, bent jau naudojamų vietiškai. Vartojant antibakterinius preparatus svarbu, kad normalios populiacijos mikroflora greitai keistųsi – reikia dažniau valyti dantis, bet atsargiai, kad nepasižeistų epitelis. Žymiai padidinti epitelio atsparumą aktyvuotų mikroorganizmų poveikiui galima plataus spektro probiotikų pagalba. Praktika tai patvirtina.
Mūsų organizme gyvena didžiulis kiekis įvairiausių pastovios mikrofloros mikroorganizmų. Jie paklūsta šeimininko organizmo įstatymams, kurių vykdymą kontroliuoja imuninė sistema, ir atneša jam didelę naudą. Bet gyvenimo eigoje gali susidaryti tokios situacijos, kai makroorganizmas ir normalios mikrofloros atstovai ima konfliktuoti. To rezultatas – destruktyvi uždegiminė reakcija. Daugelis žmogaus susirgimų – tokio konflikto pasekmė. Paskutinio dešimtmečio šiuolaikinės imunologijos pasiekimai, tarp jų ir atpažįstančių receptorių atradimas, ir šiluminio šoko baltymų studijavimas, ne tik leido suformuluoti konflikto ligų sąvoką, bet ir padėjo išaiškinti konflikto tarp organizmo ir jo normalios nuosavos mikrofloros kilimo priežastį. Čia nubrėžėme šio konflikto tik bendrus susirgimų problemų kontūrus. Ateityje neišspręstų problemų kamuolys tik didės, bet ir gautos žinios jau apverčia mūsų supratimą apie daugelio ligų patogenezę, išaiškino tarp jų netikėtus ryšius, kurie anksčiau atrodė neįmanomi.
Literatūra:
1. Лебедев К.А., Понякина И.Д. // Физиол. человека. 2006. Т.32. №2. С.224-235.
2. Bourlioux P., Koletzko B., Guarner F. et al. // Am. J. Clin. Nutr. 2003. V.78. №4. Р.675-688.
3. Cutler C.W., Jotwani R. // J. Dent. Res. 2006. V.85. №8. Р.678-686.
4. Smith D.W., Nagler-Anderson C. // J. Immunol. 2005. V.174. Р.3851-3866.
5. Cannon J.P., Lee T.A., Bolanos J.T. et al. // Eur. J. Clin. Microbiol. Infect. Dis. 2005. V.24. №1. Р.31-40.
6. Garside P., Mc Mowat A.I. // GUT. 1999. V.44. P.137-146.
7. Smith K.M., Eaton A.D., Finlayson L.M. et al. // Am. J. Respir. Crit. Care Med. 2000. V.162. №4. P.343-356.
8. Лебедев К.А. // Физиол. человека. 2003. Т.29. №2. С.138-140.
9. Лебедев К.А., Максимовский Ю.М. и др. // Стоматология для всех. 2006. №2. С.24-29.
10. Goulhen F., Grenier D., Mayrand D. // Crit. Rev. Oral Biol. Med. 2003. V.14. №6. Р.399-408.
11. Henderson B., Allan E., Coates A.R.M. // Infection and Immunity. 2006. V.74. №7. Р.3693-3706.
12. Wu T., Tanguay R.M. // Cell Stress Chaperones. 2006. V.11. №1. P.1-9.
13. Teng Y.T.A. // J. Dent. Res. 2006. V.85. №3. Р.198-208.
14. Stцllberger C., Finsterer J. // Clin Diagn. Lab. Immunol. 2002. V.9. №2. Р.207-219.
15. Gibson F.C., Hong C., Chou H.-H. et al. // Circulation. 2004. V.109. P.2801-2810.
16. Goulhen F., Hafezi A., Uitto V.-J. et al. // Infection and Immunity. 1998. V.66. №11. P.5307-5313.
Šaltinis: homosanitus.lt
...kadangi jau perskaitėte šį straipsnį iki pabaigos, prašome Jus prisidėti prie šio darbo. Skaitykite „Paranormal.lt“ ir toliau, skirdami kad ir nedidelę paramos sumą. Paremti galite Paypal arba SMS. Kaip tai padaryti? Iš anksto dėkojame už paramą! Nepamirškite pasidalinti patikusiais tekstais su savo draugais ir pažįstamais.
Susijusios naujienos:
Komentarai su keiksmažodžiais bus šalinami automatiškai, be atsiprašymo.
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau