- 2017-02-09
- 0.0 Reitingas
- 5129 Peržiūros
- Komentarai
Gripą sukeliantys virusai priklauso Orthomyxoviridae šeimai, kurią sudaro trys pagrindinės gentys (kurios literatūroje dažnai vadinamos tipais): Influenzavirus A, B, ir C (1). Šiai šeimai priskiriama ir ketvirtoji Thogotovirus gentis (kartais vadinama Influenzavirus D gentimi). Šiai genčiai priklausantys erkinės kilmės virusai struktūriškai ir genetiškai yra panašūs į A, B ir C gripo virusus (2), deja, apie juos žinoma labai mažai, todėl šioje apžvalgoje jie nebus aptariami.
Skirtingų tipų (A, B arba C) gripo virusai pirmiausia skiriasi nukleokapsidės (NP) ir matrikso (M) baltymų imunogeninėmis savybėmis. A gripo virusai yra įvairių rūšių paukščių, žmonių, kiaulių, arklių ir kai kurių kitų žinduolių parazitai; B tipui priklausantys gripo virusai natūraliomis sąlygomis infekuoja žmones ir ruonius; C gripo virusai yra žmonių, šunų ir kiaulių viršutinių kvėpavimo takų ligų sukėlėjai. A tipo gripo virusų paviršiaus glikoproteinai: kraujo ląsteles surišantis baltymas – hemagliutininas (HA) ir neuraminidazė (NA), lyginant juos su analogiškais Bgripo virusų viriono (viruso dalelės) paviršiaus baltymais, pasižymi žymiai didesne aminorūgščių įvairove. C gripo virusų vienintelis glikoproteinas – hemagliutinuojantis-esterazinis-membranų susiliejimo baltymas (HES) atlieka beveik visas viriono paviršiaus baltymams būdingas funkcijas. Nors HES baltymas savo struktūra yra panašus į A ir B gripo virusų analogiškas funkcijas atliekančius baltymus, tačiau aminorūgščių seka nuo jų labai skiriasi. A, B ir C tipams priklausantys gripo virusai skiriasi savo morfologija ir baltymų kodavimo mechanizmais, nors yra sudaryti iš labai panašių baltymų. A ir B gripo virusų genomą sudaro aštuoni RNR segmentai, C gripo virusų – septyni(3).
Hemagliutinino arba neuraminidazės imunogeninėmis savybėmis besiskiriantys A gripo virusai skirstomi į potipius. Atskiriems potipiams priklausančius baltymus neutralizuoja skirtingi serumų rinkiniai (1). Gamtoje nustatyti šešiolika HA baltymo ir devyni NA baltymo variantai, kurie tarpusavyje skiriasi antigeninėmis savybėmis (4).
Pagal dabartinę nomenklatūros sistemą taisyklingai gripo viruso pavadinimas rašomas taip: A/Swine/Iowa/15/30 (H1N1). A – žymi tipą, kuriam priklauso virusas, po to rašomas kilmės šeimininkas, toliau vieta,kurioje virusas buvo išskirtas pirmą kartą, kamieno numeris ir galiausiai – metai, kuriais šį virusą išskyrė. Skliausteliuose užrašomi hemagliutinino ir neuraminidazės antigeninių potipių numeriai (1). Žmonių kilmės virusų pavadinimuose, pagal bendrąjį susitarimą, kilmės šeimininkas nenurodomas, pvz., A/PuertoRico/8/34 (H1N1).
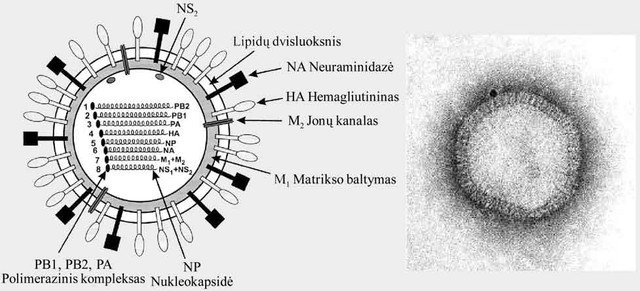
Gripo virusą sudaro lipidinio dvisluoksnio apvalkalas, kuris susiformuoja iš ląstelės šeimininko plazminės membranos ir įsiterpusių į ją viruso glikoproteinų (1 pav.). Viriono skersmuo įvairuoja 80–120 nm ribose. Gripo viruso dalelės dažniausiai yra sferinės formos, tačiau kai kurie gripo virusų variantai formuoja pailgas, netaisyklingos formos bei labai įvairaus dydžio daleles (5).
A ir B gripo virusų apvalkale yra įsiterpę dviejų tipų glikoproteinai: hemagliutininas ir neuraminidazė(3). C tipui priklausantys gripo virusai sintetina tik vieną membraninį glikoproteiną – HES (6). Integraliniai gripo virusų baltymai viriono paviršiuje formuoja 10–14 nm ilgio spyglius, kuriuos įmanoma stebėti elektroniniu mikroskopu ( pav.). Gripo viruso dalelės apvalkale aptinkamas dar vienas membraninis baltymas M2, kurio yra santykinai nedaug ir jis atlieka selektyvaus jonų kanalo funkciją (7).
Gausiausiai virione yra matrikso baltymo (M). Jis iškloja apvalkalėlio membranos vidinį paviršių ir suteikia viruso dalelei tvirtumo (1 pav.). Matrikso baltymas viruso dalelėje sąveikauja su integraliniais membranos baltymais (glikoproteinais bei jonų kanalą formuojančiu baltymu) ir viriono viduje esančiu ribonukleoproteinų kompleksu (RNP) (8). Šią struktūrą sudaro viruso genomas – viengrandės RNR molekulės, kurios kiekviena atskirai jungiasi su nukleokapsidės(NP) baltymais ir suformuoja karkasą, o su juo sąveikauja trys viruso RNR polimerazinį kompleksą sudarantys baltymai (PB1, PB2 ir PA). RNR ir baltymų junginiai virusinės dalelės viduje yra susijungę į tvarkingą stambų junginį – ribonukleoproteinų kompleksą (8).
Gripo virusų genomą sudaro segmentuota viengrandė priešprasmė RNR (kitaip vadinama – genomo RNR). A ir B tipams priklausančių virusų genomas yra aštuoni atskiri RNR segmentai (1 pav.), C tipo virusų – septyni. Nuo genomo RNR vyksta viruso informacinių RNR (iRNR) molekulių sintezė, taip pat genomo RNR yra naudojama kaip matrica antigenomoRNR sintezei (9).
1 pav. Gripo viruso dalelės modelis (kairėje) ir viriono elektroninės mikroskopijos nuotrauka, padidinimas Ā~227.500 (dešinėje)
(Lamb RA, Krug RM. Orthomyxoviridae: the viruses and their replication. In: Knipe DM, Howley PM, editors. Fields Virology. 4th ed.; 2001)
Pirmi trys didžiausi genomo segmentai koduoja nuo RNR priklausančios RNR polimerazės komplekso subvienetus: PB2, PB1, PA. Šiems baltymams susijungus į kompleksą, susiformuoja aktyvus fermentas, kuris atpažįsta transkripcijos bei replikacijos reguliacines sekas ir atlieka visų viruso RNR tipų sintezę (10).
Nukleokapsidės baltymą koduoja penktasis genomo segmentas. Šis baltymas su gripo viruso RNR molekulėmis jungiasi į ribonukleoproteinų kompleksą. NP baltymas taip pat reguliuoja kai kuriuos viruso RNR sintezės etapus (11).
Ketvirtas pagal dydį A ir B gripo virusų genomo segmentas koduoja pagrindinį paviršiaus glikoproteiną – hemagliutininą. Pirmiausia yra sintetinamas neaktyvus HA baltymo pirmtakas (HA0), kurio N-gale yra seka, nukreipianti sintetinamą hemagliutininą į endoplazminio tinklo vidinę ertmę. Į kitą membranos pusę perkeliamas beveik visas baltymas. Membranoje įstringa maždaug 27 aminorūgščių ilgio hidrofobinė baltymo dalis, o dešimt C-galinių aminorūgščių lieka endoplazminio tinklo išorėje (8). Įsitvirtinę membranoje, HA baltymai suformuoja nekovalentinėmis sąveikomis susijungusį trimerą (12). Išorinė HA baltymo dalis skirstoma į kotelį ir galvutę. Galvutė suformuoja tolimąjį glikoproteino galą, kuriame yra sialo rūgšties molekulę surišanti kišenė (13). Vieni HA baltymai savo receptoriaus kišenėje gali specifiškai surišti sialo rūgšties molekulę, kurią su galaktoze jungia a2,3 tipo jungtis, kiti hemagliutinino variantai yra specifiški a2,6 jungties tipui. Kai kurie pakitusio specifiškumo HA baltymai silpnai suriša abiejų jungties tipų sialo rūgšties molekules (14). Hemagliutinino pirmtakas (HA0) savo išorinėje dalyje turi seką, kurią atpažįsta ir kerpa baltymus hidrolizuojantis fermentas. Perkirptas HA baltymas aktyvuojasi, o aktyvuota HA baltymo forma žemo pH sąlygomis keičia savo erdvinę struktūrą. Priklausomai nuo viruso kamieno ir infekuotos ląstelės tipo, baltymą aktyvuojanti hidrolizė gali įvykti arba ląstelės viduje (glikoproteinų kelionės į ląstelės išorę metu), arba tarpląstelinėje terpėje. Aktyvuotas arba neaktyvuotas HA baltymas per endoplazminį tinklą ir Goldžio kompleksą keliauja į ląstelės plazminės membranos paviršių, kur formuojasi naujos viruso dalelės (15). Šiuose ląstelės komponentuose (endoplazminiame tinkle ir Goldžio komplekse) vyksta potransliacinės HA baltymų modifikacijos. Šios modifikacijos užtikrina teisingą baltymo susilankstymą, moduliuoja aktyvaus centro specifiškumą ir padeda hemagliutininui „pasislėpti“ nuo šeimininko imuninio atsako (16). Viruso dalelė HA baltymais prikimba prie sialo rūgštį turinčių receptorių, taigi hemagliutininas yra atsakingas už viruso dalelių adsorbciją ląstelių paviršiuje ir už endocitozės procesą, vykstantį po to.
Šeštasis A ir B gripo virusų genomo segmentas koduoja antrąjį paviršiaus glikoproteiną – neuraminidazę, kuri yra II klasės integralinis membranos baltymas. Jis N-galinėje dalyje esančia hidrofobine aminorūgščių seka įsitvirtina viruso dalelės apvalkale, turi trumpą citoplazminį domeną, o likusi baltymo dalis atsiduria viriono membranos paviršiuje. Neuraminidazės aktyvus centras hidrolizuoja a-ketosidinę jungtį tarp D-galaktozės arba D-galaktozamino ir terminalinės sialo rūgšties. NA, kaip ir hemagliutininas, sintezės metu keliauja į endoplazminio tinklo vidinę ertmę ir tik N-galine dalimi įsitvirtina šio tinklo membranoje. Po to keliauja į Goldžio kompleksą ir galiausiai yra atnešamas į ląstelės paviršių, kur formuojasi naujos viruso dalelės. Įsitvirtinusios membranoje NA baltymo molekulės jungiasi į tetramerus. NA atlieka savo funkciją jau endoplazminio tinklo viduje bei Goldžio komplekse: nuo šiose organelėse bręstančių ląstelės bei viruso membraninių glikoproteinų šalina sialo rūgšties liekanas, todėl į ląstelės paviršių patenka molekulės prie kurių nekimba viruso hemagliutininas. Tokiu būdu ląstelės, kurios visu pajėgumu replikuoja virusą, tampa neprieinamos naujai infekcijai. Neuraminidazė taip pat atskelia sialo rūgštį nuo molekulių, sudarančių kvėpavimo takus dengiantį mucino sluoksnį, todėl virusas efektyviai skverbiasi per šį sluoksnį iki epitelio ląstelių ir prikimba tik jų paviršiuje (17).
Ketvirtasis C gripo virusų genomo fragmentas koduoja vienintelį paviršiaus glikoproteiną HES. Šis baltymas turi receptorių (9-O-acetil-N-acetilneuramininę rūgštį), surišantį centrą ir esterazinį domeną (neuraminato-O-acetil esterazė). Šis baltymas atlieka ir membranų susiliejimo funkciją (6).
B gripo virusų šeštojo genomo segmento koduojama iRNR turi dvi transliacijos iniciacijos sekas. Nuo pirmosios yra transliuojamas jonų kanalą formuojantis baltymas (NB), o antroji tarnauja NA baltymo sintezei.Skirtingų funkcijų baltymus koduojančios sekos persidengia (18).
Septintasis A tipo gripo virusų genomo fragmentas koduoja du polipeptidus: matrikso baltymą (M1) ir selektyvų jonų kanalą formuojantį baltymą (M2). B gripo virusų septintasis genomo fragmentas taip pat koduoja matrikso baltymą (M1), tačiau iRNR turi kitą transliacijos iniciacijos seką, kuri prasideda už M baltymą koduojančios sekos STOP kodono. Antrasis atviras skaitymo rėmelis (ASR) koduoja BM2 peptidą, kurio funkcijos viruso replikacijos cikle dar neištirtos (19). C tipo gripo virusų matrikso baltymą koduoja šeštasis genomo fragmentas. Tačiau tik sukirpta iRNR suformuoja ASR, nuo kurio transliuojamas C virusų matrikso baltymas (CM1). Nekirptas šios iRNR variantas koduoja CM1 baltymo pirmtaką (p42). Po viduląstelinių peptidazių poveikio iš jo susiformuoja C virusų selektyvų jonų kanalą formuojantis polipeptidas (CM2) (20). Visoms grupėms priklausančių virusų matrikso baltymas yra svarbiausias virusinės dalelės morfogenezės organizatorius (3).
A ir B gripo virusų aštuntasis genomo segmentas, o C virusų septintasis koduoja du baltymus: NS1 ir NS2. NS1 yra nestruktūrinis viruso baltymas, kuris aptinkamas tiek infekuotos ląstelės citoplazmoje, tiek branduolyje (8). Jis blokuoja ląstelės iRNR pirmtako brendimo procesus, jungiasi su dvigrande RNR ir slopina infekuotos ląstelės indukuojamą interferono atsaką. Sukirpta mažiausio pagal dydį gripo virusų genomo fragmento iRNR suformuoja NS2 baltymą, koduojantį ASR. Šis baltymas su kitais ląstelės ir viruso komponentais jungiasi į kompleksą, kuris viruso ribonukleoproteinus neša iš branduolio į citoplazmą (3).
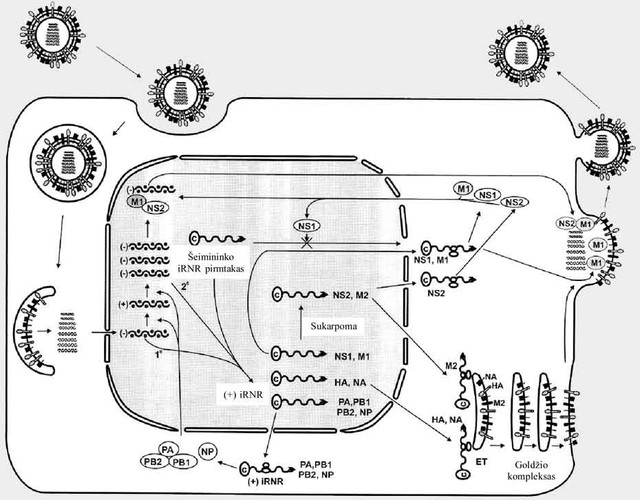
Gripo viruso raidos ciklas (2 pav.) prasideda nuo viriono prisitvirtinimo prie ląstelės šeimininko paviršiaus. Prikibimas vyksta, kai viruso paviršiaus baltymai-glikoproteinai sąveikauja su sialo rūgšties liekanomis, esančiomis ląstelės paviršinių baltymų-receptorių oligosacharidinių grandinių galuose. Sąveika vyksta ne tarp pavienio glikoproteino ir ląstelės receptoriaus, o tarp daugelio. Sąveikos taškų gausa ir stabilumas nulemia infekcijos efektyvumą, nes, gausėjant sąveikos taškams, ląstelės membrana įlinksta ir virusas patenka į ląstelės vidų susiformavus endocitotinei pūslelei (pirminei endosomai). Toliau, susiliejant pirminėms endosomoms, susiformuoja antrinė endosoma (kurioje yra viruso dalelė). Jos viduje sparčiai ima rūgštėti terpė, nes antrinės endosomos membranoje esantys protonų siurbliai sparčiai perkelia vandenilio jonus į organelės vidų, o viruso baltymai reaguoja į rūgštėjančią terpę, pakinta jų erdvinė struktūra.Viriono membranoje esantys jonų kanalai praleidžia vandenilio jonus į virusinės dalelės vidų, o tai sukelia viruso matrikso baltymo pokyčius – atsipalaiduoja sąveika tarp matrikso ir nukleoproteinų komplekso (viruso „chromosomų“). Vaizdžiai tariant, terpės parūgštėjimas skatina virusą ruoštis išleisti savo genetinę medžiagą. Tuo metu pakitusios erdvinės struktūros glikoproteinai priartina viriono ir ląstelės membranas viena prie kitos tiek, kad įvyksta susiliejimas ir atsiveria ertmė, per kurią viruso nukleoproteinai patenka į ląstelės citoplazmą (3).
2 pav. Gripo viruso raidos ciklas
(Lamb RA, Krug RM. Orthomyxoviridae: the viruses and their replication. In: Knipe DM, Howley PM,editors. Fields Virology. 4th ed.; 2001)
PA, PB1 ir PB2 – polimerazinį kompleksą formuojantys baltymai; HA – hemagliutininas; NA – neuraminidazė; M1 – matrikso baltymas; M2 – jonų kanalą formuojantis baltymas; NP – nukleokapsidės baltymas; NS1 ir NS2 – nestruktūriniai gripo viruso baltymai; ET – endoplazminis tinklas.
Viruso nukleoproteinai turi perkėlimo į branduolį signalą, todėl ląstelės pernašos sistemos neša viruso genetinę medžiaga į branduolį, o branduolyje vyksta viruso RNR sintezė. Pirmiausia yra sintetinama viruso informacinė RNR, kuri yra komplementari genomo RNR (2 pav.). Virusas pasisavina ląstelės iRNR signalinį elementą CAP, todėl viruso iRNR yra perkeliama į citoplazmą, kur vyksta viruso baltymų sintezė (iRNR transliacija). Visi viruso baltymai, išskyrus hemagliutininą, neuraminidazę ir jonų kanalą formuojantį baltymą, yra brandinami citoplazmoje, tačiau pastarieji bręsta endoplazminiame tinkle, vėliau Goldžio komplekse, o galiausiai kaupiasi ląstelės paviršiuje (plazminėje membranoje) (2 pav.). Nukleokapsidės baltymas, matrikso baltymas ir kiti iš citoplazmos yra perkeliami į branduolį (tai lemia lokalizacijos signalas), kur be iRNR pradedama sintetinti viruso genomo RNR. Nukleokapsidės baltymas sąveikauja su genomo RNR, susidaro nukleoproteinas (nukleokapsidė), prie kurios jungiasi matrikso baltymas, polimerazės subvienetai ir kiti baltymai. Susidarę nukleoproteinų kompleksai yra perkeliami iš ląstelės branduolio į citoplazmą ir keliauja plazminės membranos link, kur kaupiasi viruso paviršiniai baltymai ir formuojasi virionų susidarymo centrai. Kad susidarytų viruso dalelė, visos jos sudedamosios dalys turi susitikti viename erdvės taške. Matrikso baltymas tarpininkauja nukleoproteino kompleksams prisijungiant prie citoplazminių viruso paviršinių baltymų dalių. Toliau plazminė membrana išlinksta, apgaubdama aštuonis skirtingus nukleoproteinus, susidariusios egzocitotinės pūslelės galai suartėja, membranos kraštai susilieja ir atsiskyrusi nauja viruso dalelė patenka į aplinką. Reikėtų priminti, kad bręstanti viruso neuraminidazė Goldžio komplekse nuskelia sialo rūgšties liekanas nuo visųpaviršinių baltymų. Dėl šios priežasties užkrėstos ląstelės paviršiniai baltymai neturi sialo rūgšties, o naujos viruso dalelės lengviau atsiskiria nuo ląstelės šeimininko paviršiaus ir negali prikibti ir iš naujo užkrėsti (3).
Gripo virusai, palyginus su kitais virusais, kinta labai greitai. RNR sintezės metu gripo virusų RNR polimerazė daro daug klaidų. Šis fermentas vieno replikacijos ciklo metu, sintetindamas naują RNR grandinę, kas 10 tūkst. nukleotidų padaro po klaidą (1/104) (21). Replikacijos, kurią atlieka DNR polimerazė, klaidų dažnis yra penkiomis eilėmis mažesnis (1/109), tačiau kiti, ne taip greitai kintantys RNR virusai, replikacijos ciklo metu daro maždaug tiek pat klaidų kaip ir gripo virusas, todėl vien dideliu RNR sintezės klaidų dažniu neįmanoma paaiškinti sparčios gripo virusų evoliucijos (22). Atsitiktinis genetinės informacijos pasikeitimo procesas yra kita gripo virusų ypatybė, kuri sparčiai didina genetinę šių virusų įvairovę. Gripo virusų genomą sudaro atskiros RNR molekulės. Kai ląstelę infekuoja du virusai, kurie turi skirtingus genetinių žymenų rinkinius, tada į naujai susidarančias viruso daleles patenka įvairios skirtingiems virusams priklausančių žymenų kombinacijos (23). Gripo virusų atveju šis procesas yra panašus į mejozėje vykstantį atsitiktinį chromosomų pasiskirstymą. Kai kurių viruso genetinių žymenų pasiskirstymo dažnis gali būti artimas 50 proc. (24). Atsitiktinis genomo fragmentų pasiskirstymas yra būdingas A, B ir C gripo virusams, tačiau tarp skirtingiems tipams priklausančių virusų genų mainai nevyksta (25).
Iškėlus hipotezę, kad atskiros genomo RNR molekulės į naujai susidarančias gripo viruso daleles patenka visiškai atsitiktinai, buvo paskaičiuota, kad iš aštuonių RNR segmentų sudaryto genomo atvejų tik viena iš 416 naujų gripo viruso dalelių gali turėti visą genomo rinkinį. Tačiau gamtoje šis santykis yra kitoks. Maždaug 10 proc. viruso palikuonių yra gyvybingi (kitaip tariant, turi visą genomo molekulių komplektą) (26). Todėl buvo padarytos dvi prielaidos. Pirma, genomo segmentai yra surenkami nevisiškai atsitiktinai, o egzistuoja šį procesą kontroliuojantis mechanizmas; antra, į naują viruso dalelę kartu su genomo rinkiniu telpa papildomos RNR molekulės, iš kurių kito ciklo metu gali susiformuoti visas genomas. Dėl didelio mutacijų dažnio, atsitiktinio genetinės informacijos pasikeitimo proceso ir griežtai neapibrėžtos viriono talpos gamtoje susidaro didelė gripo virusų įvairovė (22).
Greičiausiai kinta virusų paviršiaus glikoproteinų: hemagliutinino ir neuraminidazės antigeninės savybės. Šie pokyčiai skirstomi į dvi grupes. Pirma, kai dėl mutacijų kinta antigeninius epitopus sudarančių aminorūgščių seka (šis reiškinys dar vadinamas „antigeniniu dreifu“); antrai grupei priklauso stambūs antigeniniai pokyčiai, kurių atsiranda pasikeitus visam geno segmentui arba virusui „peršokus“ rūšinį barjerą (šie reiškiniai dar vadinami „antigeniniu poslinkiu“) (22). Kiekvieno viruso likimas visiškai priklauso nuo jo parazituojamo šeimininko, todėl tarp šeimininko ir parazito turi formuotis optimalus ryšys, kuris priklauso nuo viruso replikacijos spartos, infekcijos daromos žalos ir parazito santykio su šeimininko apsaugos sistemomis (imunitetu). Paprastai, kuo senesnis šis ryšys, tuo švelnesni infekcijos padariniai parazituojamo šeimininko atžvilgiu. Žinoma, kad žmogaus gripo virusai kilo iš paukščių gripo virusų. Evoliuciniu požiūriu jie gana neseniai „peršoko“ rūšinį barjerą, todėl žmogui, skirtingai nei vandens paukščiams, gripo virusas yra labai užkratus, intensyviai dauginasi kvėpavimo takų epitelio ląstelėse, stipriai pažeidžia užkrėstus audinius, tačiau prieš šį agresyvų virusą efektyviai formuojasi stiprus imuninis atsakas, kuris neleidžia infekcijai plėstis ir tuomet virusas „sprunka“ (kitaip tariant, didelis virusinių dalelių kiekis patenka į aplinką ir gali užkrėsti kitą potencialų šeimininką). Būtent dėl efektyvios organizmo apsaugos sistemos reakcijos į infekciją toks gripo viruso ir žmogaus santykis egzistuoja, kitokiu atveju jis būtų fatališkas šeimininkui, taip pat neišvengiamai ir pačiam parazitui. Gripo virusas intensyviai dauginasi tol, kol formuojasi infekciją neutralizuojantis imuninis organizmo atsakas (1–2 savaites), o šiam kovojant su infekcija, į aplinką patenka tiek gripo viruso palikuonių, kad tinkamo tankio potencialaus šeimininko populiacijoje jų pakanka virusui plisti. Vaizdžiai tariant, toks viruso infekcijos tipas yra vadinamas „kirsk ir bėk“ (27). Kitas svarbus veiksnys, kuris turi įtakos viruso ir jo infekuojamo šeimininko santykio braižui, yra imuninės organizmo sistemos atmintis, kuri gripo viruso atveju apsaugo nuo pakartotinės infekcijos tą pačią antigeninę kompoziciją turinčiu virusu. Tačiau gripo virusas ypatingas tuo, kad santykinai lengvai gali keisti imuninės sistemos atakuojamų baltymų antigenines savybes.
Gripo virusų HA ir NA baltymai yra pagrindinis taikinys, kurį atakuoja imuninė šeimininko sistema. Prie viruso apvalkalėlio paviršiaus baltymų prisijungę specifiniai antikūnai neleidžia virusui patekti į ląstelę ir efektyviai slopina viruso infekciją. Tačiau čia išryškėja dar viena svarbi gripo viruso ypatybė: jo apvalkalėlio glikoproteinų antigeninius epitopus formuojančiuose baltymo regionuose kintanti aminorūgščių seka neturi įtakos glikoproteinų atliekamoms funkcijoms, tačiau padeda virusui išvengti jau egzistuojančio imuninio atsako prieš pirminę baltymo formą. Todėl nenuostabu, kad gamtoje egzistuoja didelė šių baltymų antigeninių epitopų įvairovė. Pagrindinės HA ir NA baltymų antigeninės sritys išsidėsto galvutės regione, aplink aktyvų centrą formuojančią kišenę. Besikaupiant mutacijoms, antigeninius epitopus formuojančių aminorūgščių sekose (smulkūs antigenų pokyčiai – „antigeninis dreifas“) susiformuoja naujas šių epitopų derinys, kurio neblokuoja prieš pirminį variantą susiformavęs imunitetas. Stipriai pakitusios antigeninės struktūros variantai susidaro maždaug per metus ar dvejus, o mažų antigeninių skirtumų atsiranda labai greitai. Šiuo būdu formuojasi nauji HA ir NA baltymų potipiai (28, 29). Didžiausia įvairove pasižymi A tipui priklausančių gripo virusų glikoproteinai. Gamtoje aptinkami A gripo virusų HA baltymai skirstomi į šešiolika potipių (4). Atskiriems potipiams priklausantys baltymai skiriasi savo antigeninėmis savybėmis (kiekvienam potipiui priklausantį HA baltymą neutralizuoja skirtingų antiserumų rinkiniai), taip pat atskiriems potipiams priklausančių baltymų aminorūgščių sekos skiriasi maždaug 30 proc. Pagal tokius pat požymius į devynis atskirus potipius suskirstyti gamtoje aptinkami A gripo virusų NA baltymai (1). B ir C tipams priklausančių gripo virusų smulkūs glikoproteinų antigenų pokyčiai vyksta žymiai lėčiau. Pavyzdžiui, gamtoje aptinkama B gripo virusų HA ir NA baltymų įvairovė yra žymiai mažesnė nei A gripo virusų, visi žinomi B gripo virusų glikoproteinų variantai priskiriami tik vienam antigeniniam potipiui (30). C gripo virusų vienintelio paviršiaus glikoproteino HES gamtoje aptinkamų variantų įvairovė taip pat yra santykinai maža. Manoma, kad B ir C gripo virusai, lyginant juos su A gripo virusais, yra labiau prisitaikę ir ne tokie agresyvūs jų šeimininkų atžvilgiu, todėl šių virusų paviršiaus baltymų antigeninė struktūra kinta žymiai lėčiau (22). „Antigeninis dreifas“ yra santykinai tolygiai vykstantis procesas, o dideli antigenų pokyčiai (kitaip tariant, antigenų poslinkiai) įvyksta staiga. Jie susidaro dviem būdais. Pirmas būdas: atsiranda atsitiktinio genetinės informacijos pasikeitimo metu, kai paviršiaus glikoproteinus koduojantį genomo segmentą pakeičia kitam antigeniniam viruso potipiui priklausantis tą patį baltymą koduojantis segmentas; antras būdas: viruso komponentai pakinta taip, kad virusas gali parazituoti kitos rūšies šeimininką. Stipriai pakitusios antigeninės struktūros virusų nepažįsta imuninė puolamo organizmo sistema, todėl jie įgyja potencialą sukelti naują epidemijos protrūkį. „Antigeniniai poslinkiai“ yra didžiųjų gripo viruso pandemijų priežastis (22, 31).
Visiems žinomiems A gripo virusų potipiams priklausantys virusai buvo išskirti iš vandens paukščių. Didžioji dalis įvairių A gripo virusų parazituoja laukinius vandens paukščius: antis, žąsis, žuvėdras, audrapaukščius bei kirus. Taip pat skirtingi A gripo virusai infekuoja įvairias naminių paukščių rūšis: kalakutus, vištas, putpeles, fazanus, namines žąsis ir antis. Rečiau šie gripo virusai yra žvirblinių šeimos kenkėjai (4, 32). Paukščius parazituojantys A gripo virusai dažniausiai dauginasi žarnyno epitelio ląstelėse ir nesukelia jokių ligos simptomų, tik keli A gripo virusų variantai (H5 ir H7 potipiams priklausantys virusai) sukelia sisteminę infekciją, kuri pažeidžia net centrinę nervų sistemą, o mirtis užsikrėtusį paukštį ištinka vienos savaitės laikotarpiu. Kai kurie A gripo virusų potipiai infekuoja paukščių kvėpavimo takų epitelį. Kalakutams šie virusų variantai sukelia lėtinę kvėpavimo takų ligą. Paukščius puolantys gripo virusai daugeliu atvejų replikuojasi žarnyno ląstelėse, todėl dideli virusų kiekiai į aplinką patenka su ekskrementais į ežerų pakrantes ir į vandenį. Dėl šių ypatybių paukščių gripo virusai sėkmingai cirkuliuoja vandens ir naminių paukščių rūšyse, gana lengvai pasiekia vandenyje gyvenančius žinduolius, naminius gyvulius ir žmones, o jų geografinis arealas efektyviausiai plečiasi dėl migruojančių paukščių. Remiantis genų sekų analize bei nuosaikiu infekcijos pobūdžiu, galima manyti, kad vandens paukščių A gripo virusų ir jų parazituojamų šeimininkų santykis yra pasiekęs adaptacinį maksimumą, tai yra toks parazito–šeimininko ryšys, kai virusas geba palaikyti jo egzistavimui reikalingą replikacinį tempą, o viruso replikacijos metu padaryta žala daro minimalią įtaką šeimininko gyvybinėms funkcijoms ir jo savijautai. Todėl vandens paukščių rūšys yra tarsi rezervuaras, kuriame saugiai cirkuliuoja įvairūs A gripo virusų variantai. Jiems kintant ar maišantis tarpusavyje, formuojasi nauji variantai, kurie gali „peršokti“ rūšinį barjerą ir sukelti gripo epidemijos protrūkius įvairiose žinduolių rūšyse (pvz., žmonėse, kiaulėse ir t. t.). Filogenetinė analizė parodė, kad laukiniai vandens paukščiai yra pirminis rezervuaras, iš kurio kilo visas paukščių ir žinduolių rūšis terorizuojantys gripo virusai (22, 31, 32).
Kiaules parazituoja keli A gripo virusų variantai: tik kiaules užkrečiantis H1N1 gripo viruso variantas, variantas giminingas paukščių H1N1 virusui, variantas giminingas žmogaus H1N1 virusui bei H3N2 potipiui priklausantys gripo virusai. Kiaulės organizme šių virusų taikinys yra kvėpavimo takų epitelis. Atsiradus infekcijai, pasireiškia šie simptomai: kosulys, karščiavimas, suintensyvėjęs alsavimas ir junginės uždegimas. Kiaulės yra ypatingos tuo, kad jų ląstelių paviršiuje dominuoja abiejų jungčių tipų (a2,3 ir a2,6) receptoriai. Pirmasis jungties tipas yra būdingas paukščių žarnyno epitelio ląstelėms, todėl paukščius parazituojantys A gripo virusai atpažįsta tik a2,3 jungtį, o antrąjį jungties tipą turintys receptoriai aptinkami žmonių kvėpavimo takų epitelyje. Žmogaus gripo virusai prisitvirtina tik šią jungtį turinčių ląstelių paviršiuje, tačiau nei vandens paukščių, nei žmogaus gripo virusams prieinamų audinių ląstelių paviršiuje esantys receptoriai nėra vienodai turtingi abiem jungčių tipais prie galaktozės prisitvirtinusių sialo rūgščių, todėl kiaulės yra toks šeimininkas, kuriame skirtingas rūšis parazituojantys A gripo virusai gali efektyviai keistis genetine informacija (33). Manoma, kad 1918–1919 metų „ispanišką“ pandemiją sukėlęs H1N1 gripo virusas atkeliavo iš vandens paukščių rezervuare cirkuliavusių virusų, tačiau jo adaptacija, leidusi šiam virusui „peržengti“ rūšinį barjerą, galėjo įvykti būtent kiaulėse (34).
A gripo virusai taip pat yra kitų žinduolių rūšių parazitai: arklių, ruonių, banginių ir audinių. Dažniausiai gripo virusų infekcija pažeidžia šių žinduolių kvėpavimo sistemą, tačiau ruoniuose virusai buvo aptikti ir smegenų ląstelėse, o audinėse A gripo virusai sukelia sisteminę infekciją. Šių žinduolių rūšių virusų kilmės šaltinis taip pat yra vandens paukščiai (22). Šie gripo viruso ekologijos faktai rodo, kad A tipui priklausantys gripo virusai turi didelį potencialą keisti parazituojamo šeimininko rūšį. Dažniausiai iš vandens paukščių atkeliavę virusai netikėtai užklumpa žinduolių ir naminių paukščių rūšis, kuriose vienu atveju sukelia didelę žalą atnešančią pandemiją ir vėliau įsitvirtina naujoje ekologinėje nišoje, kitu atveju (pvz., ruonių, banginių arba audinių atveju) naujo viruso sukeliamos epidemijos baigiasi savaime, o jas sukėlę virusai tiesiog išnyksta (31).
Pagrindinis dėmesys krypsta į tuos A gripo virusus, kurių sukeliamos epidemijos kiekvienais metais padaro daug žalos žmonių sveikatai ir net nusineša nemažai gyvybių. 20 a. pradžioje, izoliavus pirmąjį žmonių gripo virusą, pradėti intensyvūs tyrinėjimai, todėl epidemiologiniai duomenys yra griežtai registruojami iki dabar. Seroarcheologiniai tyrimai parodė, kad maždaug nuo 1889 iki 1900 m. žmonių populiacijoje klestėjo H2N2 antigeniniam potipiui priklausantys gripo virusai (35). 1900 m. H2N2 potipį išstūmė H3N8 potipio virusai (36), o 1918–1919 m., kaip jau minėta, iš vandens paukščių rezervuaro (kaip spėjama per kiaules) atkeliavo ir įsitvirtino H1N1 antigeninio potipio virusas, nušlavęs apie 50 milijonų žmonių gyvybių visame pasaulyje. Kadangi visi šią pandemiją sukėlusio viruso genai atkeliavo tiesiogiai iš paukščių, todėl staiga atsiradęs virusas buvo visiškai nepažįstamas žmonių imuninei sistemai. Lyginant šią pandemiją su kitų metų epidemijomis, jos metu siautusios gripo ligos simptomai ir klinikinė šios ligos eiga buvo panaši (virusas pažeisdavo tik kvėpavimo takus), tačiau „ispaniška“ pandemija skyrėsi keliais esminiais požymiais. Pirma, žymiai dažniau atsirasdavo sunkių plaučių uždegimo komplikacijų; antra, jautriausia žmonių grupė buvo neįprastai jauno amžiaus (20–40 metų asmenys) (34). Manoma, kad už stiprų virulentiškumą labiausiai yra atsakingas H1 baltymas. H1N1 antigeninio potipio virusai žmonių populiacijoje vyravo iki 1957 m. Tais metais Azijoje pasirodė naujas gripo virusas, kurio paviršiaus baltymai turėjo H2N2 potipiui būdingus imunogeninius žymenis. Nustatyta, kad tuomet cirkuliavusių H1N1 potipio gripo virusų HA, NA ir PB1 baltymus koduojantys genai buvo pakeisti H2N2 antigeniniam potipiui priklausančių vandens paukščių virusų analogiškais genais. Atsitiktinio genetinės informacijos pasikeitimo būdu susiformavo naujų imunogeninių savybių virusas, kuris greitai išplito visame pasaulyje ir pasiėmė iki milijono žmoniųgyvybių. 1968 m. pandemija, kurios židinys atsirado Honkonge, buvo maždaug du kartus švelnesnė, nes šią epidemiją sukėlęs H3N2 gripo virusas skyrėsi nuo savo pirmtako tik vienu pagrindiniu paviršiaus antigenu – HA baltymu. Šį glikoproteiną ir polimerazės subvienetą (PB1) koduojantys genai taip pat atkeliavo iš vandens paukščių rezervuaro. H3N2 antigeninio potipio gripo virusai žmonių populiacijoje cirkuliuoja visame pasaulyje iki šiandien, kartu su taip pat sėkmingai gyvuojančiais 1950 m. „laidos“ H1N1 potipio virusais, kurie (kaip spėjama) 1977 m. „pabėgo“ iš „skylėto“ laboratorijos šaldytuvo Rusijoje, sukelia kasmetinius šaltojo sezono gripo ligos protrūkius (22).
Prie jau minėtų protrūkių prisideda ir B tipui priklausantys gripo virusai. Šių virusų sukeliamos epidemijos savo dinamika, savybėmis ir ligos simptomais yra labai panašios į A gripo virusų epidemijas, tačiau jos vyksta žymiai rečiau (37). B gripo virusų antigeninė struktūra, kaip jau minėta, kinta žymiai lėčiau. Šie virusai neturi didelio skirtingų antigeninių variantų rezervuaro, kokį turi A gripo virusai. Manoma, kad B tipui priklausantys gripo virusai yra labiau prisitaikę prie savo šeimininko, todėl yra žymiai nuosaikesni (22). Tuo tarpu C gripo virusai žmonėms sukelia tik nežymius viršutinių kvėpavimo takų sutrikimus, kurie neturi jokių sunkesnių padarinių, todėl šios grupės virusai žmogui nekelia didesnio pavojaus.
Pagrindinės A ir B gripo virusų sukeliamų gripo epidemijų charakteristikos yra šios (31, 22):
1. Neegzistuoja latentinės žmonių gripo virusų infekcijos; žmonių populiacijoje ūminės infekcijos metu virusas iš vieno asmens į kitą plinta lašiniu būdu.
2. Užkratui patekus į izoliuotą bendruomenę, virusas paplinta žaibiškai.
3. Pagrindiniai užkrato pernešėjai yra ikimokyklinio ir mokyklinio amžiaus vaikai.
4. Dideliame mieste gripo viruso aktyvumas gali būti registruojamas beveik kiekvieną mėnesį, tačiau naujus infekcijos protrūkius sukelia egzogeniniai virusų šaltiniai.
5. Globaliai kiekvienais metais cirkuliuoja ribotas viruso padermių skaičius.
6. Pavasario antrojoje pusėje pakitusių imunogeninių savybių viruso sukelta mini epidemija (dar vadinama „pranašo banga“) yra pagrindinis indikatorius, kuris perspėja apie kitų metų žiemos epidemiją.
7. Minimalus populiacijos tankis, kurio pakaktų gripo virusų plitimui ne sezono metu palaikyti, nežinomas.
8. Globaliai gripo virusai kurioje nors pasaulio dalyje aptinkami pacientuose beveik kiekvieną metų mėnesį.
9. A gripo virusai gali išgyventi santykinai nedidelės drėgmės sąlygomis. Šios sąlygos yra žiemos metu, gyvenamosiose patalpose.
10. Bendruomenei užsikrėtus gripu, staigiai susiformuoja vienas pagrindinis viruso aktyvumo pikas, kurį rodo žymiai padidėjusi mokyklinė bei pramoninė pravaikšta ir šiek tiek vėliau padidėjęs mirtingumas.
11. Jautriausia gripo viruso infekcijai bendruomenės dalis yra jauni (iki 20 metų), vyresnio amžiaus (nuo 65 metų) bei įvairiomis ligomis sergantys asmenys.
12. Epidemijos dydžiui ir padariniams labai didelės įtakos turi imunologinė populiacijos būsena.
1997 m. viso pasaulio dėmesys vėl buvo sutelktas į Honkongą, kur 18 žmonių buvo nustatyta gripo infekcija, iš jų šeši mirė. Šie atvejai sukėlė visuotinį susidomėjimą, kai tapo aišku, kad jų kaltininkas yra naujam A gripo virusų potipiu (H5N1) priklausantis virusas, kurio visi genai atkeliavo iš vandens paukščių (HA genas iš laukinių žąsų viruso A/goose/Guangdong/1/96 (H5N1) (38), o NA ir visi kiti viruso genai iš antį kryklę arba putpelę parazituojančių virusų [A/teal/HK/W312/97 (H6N1) (39) arba A/quail/HK/G1/97 (H9N2) (40)]). Negana to, šis naujas virusas išplito ir naminių paukščių rūšyse; jis puikiai dauginasi įvairiuose vištų organizmo audiniuose, todėl sukelia sisteminę infekciją, kuri dažniausiai baigiasi mirtimi. Naujuoju gripo virusu užsikrėtusių naminių paukščių mirtingumo dažnis svyruoja nuo 70 iki 100 proc. 1997 m. gruodžio 29 ir 30 dienomis Honkongo mieste buvo sunaikinta 1,6 milijono naminių paukščių ir tai atlikta kelias dienas prieš Honkonge pasirodant tuo metu cirkuliavusio žmonių gripo viruso variantui A/Sydney/05/95 (H3N2) (22). Manoma, kad naminių paukščių naikinimas žymiai sumažino genų mainų tarp H5N1 ir H3N2 virusų tikimybę. Po šių įvykių sunerimo visas pasaulis. Pagrindinės visuotinio nerimo priežastys yra šios: visiškai naujas gripo virusas, kuris turi didelį potencialą sukelti pandemiją, nes jo neatpažįsta žmonių imuninė sistema; tik iš paukščių virusų kilę genai puikiai funkcionuoja žmogaus kvėpavimo takų ląstelėse. Tai rodo, kad vandens paukščių rezervuare cirkuliuojantys H5N1 antigeninio potipio virusų variantai gali „peršokti“ paukščius ir žmones skiriantį rūšinį barjerą; šie nauji virusai turi didelio patogeninio potencialo hemagliutinino variantą H5. Laukiniuose ir naminiuose paukščiuose tokį HA variantą turintys virusai gali sukelti sisteminę infekciją (gali daugintis įvairiuose organizmo audiniuose) (41). H5N1 gripo viruso variantas cirkuliuoja naminiuose paukščiuose, todėl žmonės jam yra tarsi ranka pasiekiami, ypač Azijos miestuose, kur naminių paukščių mini fermos yra labai populiarios vidiniuose gyvenamųjų namų kiemuose, tankiai apgyvendintuose miesto rajonuose (42). Žmones užkrečiančių H5N1 virusų efektyviai neveikia kitiems A gripo virusų potipiams veiksmingos priešinfekcinės terapijos priemonės (pvz., amantadinas arba rimantadinas). Negana to, standartiniais metodais neįmanoma gaminti vakcinų nuo H5N1 potipio virusų (vakcinų nuo gripo virusų gamybai naudojami apvaisinti vištos kiaušiniai), nes H5N1 potipio virusas embriono ląstelėse replikuojasi taip intensyviai, kad nužudo besivystantį embrioną (22). Deja, kol kas neįmanoma efektyviai padauginti šį virusą standartiniu būdu ir pasiūlyti rinkai pakankamai pigią vakciną.
Taigi, H5N1 antigeninio potipio virusas sugebėjo „peršokti“ rūšinį barjerą ir sukelti didelį juo užsikrėtusių žmonių mirtingumą, tačiau jam dar nepavyko išplisti, nes užsikrėtę žmonės (bent jau iki šiol) negali perduoti šio viruso kitam žmogui. Šis gripo viruso variantas savo HA baltymu gali prikibti tik prie tų epitelio ląstelių, kurios iškloja žemutinius kvėpavimo takus, o tokiu atveju turbūt iš infekuoto organizmo į aplinką patenka pernelyg mažai viruso palikuonių, kad naujasis gripo virusas sėkmingai plistų (43). Dėl šios priežasties H5N1 potipiui priklausančio viruso pavienės infekcijos iki dabar nevirto visuotine epidemija, kuri, jei tokia atsitiktų (o tikimybė yra pakankamai didelė), pasak PSO (angl. World Health Organization – WHO) ekspertų, gali virsti pandemija. Remiantis PSO ekspertų prognoze, geriausiu epidemijos eigos atveju žūtų 5 mln. žmonių, blogiausiu – 150 milijonų (42). Naujausi duomenys rodo, jog H5N1 virusas jau nusinešė apie 100 žmonių gyvybių visame pasaulyje (42). Šis skaičius yra mažas palyginus, pavyzdžiui, su kasmetėmis žmonių populiacijoje dabar cirkuliuojančio H3N2 potipio gripo virusų aukomis (maždaug 30 tūkst. gyvybių kasmet vien tik JAV (34)). Tačiau, atsižvelgus į naujojo H5N1 viruso infektyvumo ir virulentiškumo potencialą, minėtas skaičius atrodo grėsmingai.
Mindaugas Juozapaitis, Linas Antoniukas
Biotechnologijos instituto Eukariotų genų inžinerijos laboratorija, Vilnius
Literatūra
1. WHO Memorandum. A revised system of nomenclature for influenza viruses. Bull WHO 1980;58:585-91.
2. Leahy MB, Dessens JT, Weber F, Kochs G, Nuttall PA. The fourth genus in the Orthomyxoviridae: sequence analyses of two Thogoto virus polymerase proteins and comparison with influenza viruses. Virus Res 1997;50:215-24.
3. Palese P, Shaw ML. Orthomyxoviridae: the viruses and their replication. In: Knipe DM, Howley PM, editors. Fields Virology. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2007. p. 1648-89.
4. Olsen B, Munster VJ, Wallensten A, WaldenstroĀNm J, Osterhaus ADME, Fouchier RAM. Global patterns of influenza a virus in wild birds. Science 2006;312:384-8.
5. Compans RW, Choppin PW. Reproduction of myxoviruses. In: Fraenkel-Conrat H, Wagner RR, editors. Comprehensive virology, vol. IV. New York: Plenum Press; 1975. p. 179-252.
6. Herrler G, Rott R, Klenk HD, Müller HP, Shukla AK, Schauer R. The receptor-destroying enzyme of influenza C virus is neuraminate-O-acetylesterase. EMBO J 1985;4:2711-20.
7. Lamb RA, Holsinger LJ, Pinto LH. The influenza A virus M2 ion channel protein and its role in the influenza virus life cycle. In: Wimmer E, editor. Receptor-mediated virus entry into cells. NY: Cold Spring Harbor Press; 1994. p. 303-21.
8. Lamb RA. Genes and proteins of the influenza viruses. In: Krug RM, editor. The influenza viruses. New York: Plenum Press; 1989. p. 1-87.
9. Lamb RA, Choppin PW. The gene structure and replication of influenza virus. Annu Rev Biochem 1983;52:467-506.
10. Torreire E, Schoehn G, FernaĀLndez Y, Jorba N, Ruigrok RWH, Cusack S, et al. Three-dimensional model for the isolated recombinant influenza virus polymerase heterotrimer. Nucl Acids Res 2007;35:3774-83.
11. Winter G, Fields S. The structure of the gene encoding the nucleoprotein of human influenza virus A/PR/8/34. Virology 1981;114:423-8.
12. Wilson IA, Skehel JJ, Wiley DC. Structure of the haemagglutinin membrane glycoprotein of influenza virus at 3 AĀč resolution. Nature 1981;289:366-73.
13. Skehel JJ, Wiley DC. Receptor binding and membrane fusion in virus entry: The influenza hemagglutinin. Annu Rev Biochem 2000;69:531-69.
14. Weis W, Brown JH, Cusack S, Paulson JC, Skehel JJ, Wiley DC. Structure of the influenza virus haemagglutinin complexed with its receptor, sialic acid. Nature 1988;333:426-31.
15. Ruigrok RWH, Wrigley NG, Calder LJ, Cusack S, WhartonSA, Brown EB, et al. Electron microscopy of the low pH structure of influenza virus haemagglutinin. EMBO J 1986; 5:41-9.
16. Doms RW, Lamb RA, Rose JK, Helenius A. Folding and assembly of viral membrane proteins. Virology 1993;193: 545-62.
17. Palese P, Tobita K, Ueda M, Compans RW. Characterization of temperature sensitive influenza virus mutant defective in neuraminidase. Virology 1974;61:397-410.
18. Shaw MW, Choppin PW, Lamb RA. A previously unrecognized influenza B virus glycoprotein from a bicistronic mRNA that also encodes the viral neuraminidase. Proc Natl Acad Sci USA 1983;80:4879-83.
19. Briedis DJ, Lamb RA, Choppin PW. Sequence of RNA segment 7 of the influenza B virus genome: partial amino acid homology between the membrane proteins (M1) of influenza A and B viruses and conservation of a second open reading frame. Virology 1982;116:581-8.
20. Pekosz A, Lamb RA. Influenza C virus CM2 integral membrane glycoprotein is produced from a polypeptide precursor by cleavage of an internal signal sequence. Proc Natl Acad Sci USA 1998;95:13233-8.
21. Scholtissek C. Influenza virus genetics. Adv Genet 1979;20: 1-36.
22. Wright PF, Neumann G, Kawaoka Y. Orthomyxoviruses. In: Knipe DM, Howley PM, editors. Fields Virology. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2007. p. 1691- 740.
23. Burnet FM, Lind PE. A genetic approach to variation in influenza viruses. 3. Recombination of characters in influenza virus strains used in mixed infections. J Gen Microbiol 1951; 5:59-66.
24. Tobita K. Genetic recombination between influenza viruses A0/NWS and A2/Hong Kong. Arch Gesamte Virusforsch 1979;23:263-6.
25. Sugiura A. Influenza virus genetics. In: Kilbourne ED, editor. The influenza viruses and influenza. Orlando: Academic Press; 1975. p. 171-214.
26. Donald HB, Isaacs A. Counts of influenza virus particles. J Gen Microbiol 1954;10:457-64.
27. Hangartner L, Zinkernagel RM, Hengartner H. Antiviral antibody responses: the two extremes of a wide spectrum. Nature 2006;6:231-43.
28. Webster RG, Hinshaw VS, Berton MT, Laver WG, Air G. Antigenic drift in influenza viruses and association of biological activity with the topography of the hemagglutinin molecule. In: Nayak DP, Fox CF, editors. Genetic variation among influenza viruses, ICN-UCLA Symposium on molecular and cellular biology, Vol. 21. Orlando: Academic Press; 1981. p. 309-22.
29. Paniker CK. Serological relationships between the neuraminidase in influenza viruses. J Gen Virol 1968;2:385-94.
30. Air GM, Gibbs AJ, Laver WG, Webster RG. Evolutionary changes in influenza B are not primarily governed by antibody selection. Proc Natl Acad Sci USA 1990;87:3884-8.
31. Webster RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka Y. Evolution and ecology of influenza A viruses. Microbiol Rev 1992;56:152-79.
32. Hinshaw VS, Webster RG, Bean WJ, Sriram G. The ecology of influenza viruses in ducks and analysis of influenza viruses with monoclonal antibodies. Comp Immunol Microbiol Infect Dis 1981;3:155-64.
33. Scholtissek C, Hinshaw VS, Olsen CW. Influenza in pigs and their roles as the intermediate host. In: Nicholson KG, Webster RG, Hay AJ, editors. Textbook of influenza. Oxford: Blackwell Science; 1998. p. 137-45.
34. Reid AH, Taubenberger JK. The origin of the 1918 pandemic influenza virus: a continuing enigma. J Gen Virol 2003;84: 2285-92.
35. Mulder J, Masurel N. Pre-epidemic antibody against 1957 strain of Asiatic influenza in serum of older people living in the Netherlands. Lancet 1958;1:810-4.
36. Enserink M. Influenza: what came before 1918? Archaeovirologist offers a first glimpse. Science 2006;312:1725.
37. Simonsen L, Clarke MJ, Williamson GD, Stroup DF, Arden NH, Schonberger LB. The impact of influenza epidemics on mortality: introducing a severity index. Am J Public Health 1997;87:1944-50.
38. Xu X, Subbarao K, Cox NJ, Guo Y. Genetic characterization of the pathogenic influenza A/goose/Guangdong/1/96 (H5N1) virus: similarity of its hemagglutinin gene to those of H5N1 viruses from the 1997 outbreaks in Hon Kong. Virology 1999;261:15-9.
39. Hoffman E, Stech J, Leneva I, Krauss S, Scholtissek C, Chin PS, et al. Characterization of the influenza A gene pool in avian species in Southern China: was H6N1 a derivative or precursor of H5N1? Virology 2000;74:6301-15.
40. Guan Y, Shortridge KF, Krauss S, Webster RG. Molecular characterization of H9N2 influenza viruses: were they the donors of the “internal” genes of H5N1 viruses in Hon Kong? Proc Natl Acad Sci USA 1999;96:9363-7.
41. Swayne DE. Understanding the complex pathobiology of high pathogenicity avian influenza viruses in birds. Avian Dis 2007;51:242-9.
42. World Health Organization (WHO). Avian influenza (“bird flu”) – Fact sheet. Available from: URL: http://www.who.int/ mediacentre/factsheets/avian_influenza/en/
43. van Reil D, Munster VJ, de Wit E, Rimmelzwaan GF, Fouchier RAM, Osterhaus ADME, et al. H5N1 virus attachment to lower respiratory tract. Science 2006;312:399.
Remiantis: http://www.homosanitus.lt/lt/homo_sanitus/turinys/virusologija_bakteriologija/Gripo_virusas
Pasaulio naujienas kitaip... skaitykite Paranormal Telegram, FB ir X(twitter) kanale...kadangi jau perskaitėte šį straipsnį iki pabaigos, prašome Jus prisidėti prie šio darbo. Skaitykite „Paranormal.lt“ ir toliau, skirdami kad ir nedidelę paramos sumą. Paremti galite Paypal arba SMS. Kaip tai padaryti? Iš anksto dėkojame už paramą! Nepamirškite pasidalinti patikusiais tekstais su savo draugais ir pažįstamais.
Susijusios naujienos:
Komentarai su keiksmažodžiais bus šalinami automatiškai, be atsiprašymo.
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau
Skaityti daugiau